1、选择题 下列反应,既属于化合反应又属于氧化还原反应的是(? )?
A.2Mg+O2 2MgO
2MgO
B.CO2+H2O=H2CO3
C.Fe+CuSO4=Cu+FeSO4
D.Ba(OH)2+H2SO4=BaSO4↓+2H2O
参考答案:A
本题解析:试题分析:有元素化合价发生改变的化学反应属于氧化还原反应。
本题难度:简单
2、选择题 判断下列反应中氧化性强弱(? )
①I2+SO2+2H2O====2HI+H2SO4?②2FeCl2+Cl2====2FeCl3③2FeCl3+2HI====2FeCl2+2HCl+I2
A.I2>Fe3+>Cl2>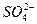
B.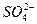 >Fe3+>Cl2>I2
>Fe3+>Cl2>I2
C.Cl2>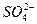 >Fe3+>I2
>Fe3+>I2
D.Cl2>Fe3+>I2>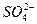
参考答案:D
本题解析:对一般氧化还原反应,氧化性:氧化剂>氧化产物;?还原性:还原剂>还原产物。
本题难度:简单
3、简答题 (13分)我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO? ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为??;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为?。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式?。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费,?为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:

①试剂Y的名称?;物质X最好是?(填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol·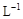 ,?则加入Cl2气和物质X使溶液的pH在??范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、? KSP[Cu(OH)2]=2.0×10—20?、?lg5=0.7)
,?则加入Cl2气和物质X使溶液的pH在??范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、? KSP[Cu(OH)2]=2.0×10—20?、?lg5=0.7)
参考答案:(13分)
(1)1﹕6 (2分), 7.5mol(3分,没单位扣1分)。
(2)Cu2O+2H+=Cu+Cu2++H2O (2分,没配平扣1分,化学式错0分)
(3)①盐酸或氯化氢(1分);CuO (2分)。② 3.0—4.3(3分)
本题解析:(1) Cu2S+ 2Cu2O="6Cu+" SO2中,被氧化的元素即化合价升高的元素是S元素,被还原的元素即化合价降低的元素是Cu元素,由方程式可知,③中被氧化与被还原元素原子的物质的量之比为1:6;
由①得6CuFeS2~12O2~3Cu2S; 由②得 2Cu2S ~ 3O2~2Cu2O, 由③Cu2S~ 2Cu2O~6Cu,所以最终得关系式6CuFeS2~15O2~6Cu,若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为7.5mol;
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,根据氧化还原反应理论,蓝色溶液为硫酸铜溶液,红色固体为单质铜,离子方程式为Cu2O+2H+=Cu+Cu2++H2O;
(3)①由氢氧化铁生成氯化铁,需要试剂Y是稀盐酸或氯化氢;加入X的目的是调节溶液pH,使铁离子沉淀,所以为了不引入新的杂质,X最好选择CuO;
②加入氯气后铜离子的浓度仍是0.5mol/L,铁离子的浓度为1.0mol/L,根据所给沉淀的溶度积计算氢氧化铁完全沉淀时的c(OH-)3=1.0×10—38 /1.0×10—5mol·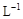 , 则c(OH-)=1.0×10—11mol·
, 则c(OH-)=1.0×10—11mol·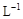 , pH=3;当铜离子开始沉淀时,c(OH-)2=2.0×10—20 /0.5=4.0×10—20mol·
, pH=3;当铜离子开始沉淀时,c(OH-)2=2.0×10—20 /0.5=4.0×10—20mol·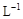 ,c(OH-)=2.0×10—10mol·
,c(OH-)=2.0×10—10mol·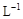 ,pH=4.3,所以铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀时溶液对pH的范围是3.0—4.3。
,pH=4.3,所以铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀时溶液对pH的范围是3.0—4.3。
本题难度:一般
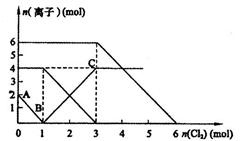
4、填空题 (7分)、向FeI2、FeBr2的混合 溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。
溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。
已知:2Fe2++Br2 2Fe3++2Br-?2Fe3++2I-
2Fe3++2Br-?2Fe3++2I- 2Fe2++I2
2Fe2++I2
(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为  。
。
(2)当通入2mol Cl2时,溶液中已发生的离子反应可表示为: 。
(3)原混合溶液中FeBr2的物质的量为 。
(4)原溶液中:c (Fe2+)∶c (I-)∶c (Br-)= 。
参考答案:(1)I->Fe2+>Br-(提示:反应知)
(2)2Fe2++2I-+2Cl2 2Fe3++I2+4Cl-(提示:结合图知AB段表示I-,BC段表示Fe3+)
2Fe3++I2+4Cl-(提示:结合图知AB段表示I-,BC段表示Fe3+)
(3)3mol?(4)2∶1∶3
本题解析:略
本题难度:简单
5、选择题 某氮的氧化物和灼热的铁按4NxOy+3yFe=yFe3O4+2xN2的反应式进行反应。在一个特定的实
验中,2mol该氧化物与足量红热的铁完全反应,生成1molN2和1molFe3O4。该氧化物的化学式为(?)
A.NO
B.NO2
C.N2O
D.N2O4
参考答案:B
本题解析:生成1mol四氧化三铁转移8mol电子,则生成1mol氮气就转移8mol电子,所以平均1个氮原子得到4个电子,所以氧化物中氮元素的化合价是+2价,答案选B。
本题难度:一般