1、填空题 (1)微粒X2-核外有18个电子,该离子的结构示意图?。
(2)由1H216O与2H217O所代表的物质中,共有?种元素,?种原子,16O、17O的关系为?。
(3)已知:碳元素有12C、13C、14C;氧元素有16O、17O、18O,则它们能够形成?种CO2分子。
参考答案:(1) ⑵2,4,同位素? ⑶? 18?;
⑵2,4,同位素? ⑶? 18?;
本题解析:(1)X2-核外有18个电子,带两个单位的负电荷,则该微粒的质子数为16;(2)同种元素用同一符号表示,不同的核素表示不同的原子;(3)CO2由一个碳原子和两个氧原子构成,碳、氧均有三种核素,两个氧原子可为同一核素,也可为不同核素,故总共有18种组合。
点评:对化学用语的考查是高考必考知识点,难度不大,考生在平时的学习过程中应注意化学用语的规范使用。
本题难度:一般
2、选择题 下列化学用语使用正确的是
A.表示H2燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(l) △H=—483.6kJ/mol
B.NH4Cl电子式: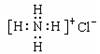
C.苯乙醛结构简式: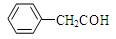
D.丙烷分子的球棍模型:
参考答案:D
本题解析:略
本题难度:一般
3、选择题 我国稀土矿资源丰富,品位甚高。提取稀土元素可以向含RE(RE表示稀土元素)的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转入沉淀。有关的反应为(RE)2(SO4)3+Na2SO4+xH2O (RE)2(SO4)3·Na2SO4·xH2O↓。下列叙述不正确的是(?)
(RE)2(SO4)3·Na2SO4·xH2O↓。下列叙述不正确的是(?)
A.该反应属于化合反应
B.该反应属于可逆反应
C.生成的产物在分类上属于复盐
D.RE在化合物中的化合价为+3
参考答案:B
本题解析:该反应“多变一”,属于化合反应,A正确;该反应的正、逆过程不是同条件,也不同时,不是可逆反应,B不正确;生成物中含有两种金属阳离子、一种酸根阴离子,符合复盐的定义,C正确。
本题难度:一般
4、填空题 (12分)钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
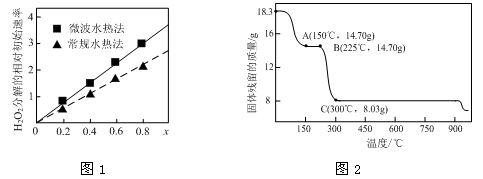
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
参考答案:(1)①+3 ②微波水热 Co2+
(2)① Co3O4(写成CoO·Co2O3亦给分) 3CoC2O4 + 2O2 = Co3O4 +6CO2
②由电子守恒:n(Co3+) =" 2" n(Cl2) =" 0.4" mol(1分)
由电荷守恒:n(Co)总=n(Co2+)溶液=" 0.5" n(Cl-) =" 0.5×(" 2.4mol-0.2mol×2)=" 1" mol
所以固体中的n(Co2+)= 1mol-0.4mol=" 0.6" mol(1分)
n(O)=(0.4mol×3+0.6mol×2)÷2=1.2mol(1分)
故n(Co):n(O)=1mol:1.2mol=5:6(1分)
(除第(1)②小题每空1分,第(2)②小题4分外,其余每空2分,共12分)
本题解析:(1)①该催化剂中Co、Ni均为+2价,O为-2价,所以Fe元素的化合价是[8-(2x+2-2x)]/2=+3;
②反应速率越快,则催化剂的催化活性越高,根据图像可知,x相同时微波水热法初始反应速率大于常规水热法,所以微波水热法制取得到的催化剂活性更高;随x增大,初始速率增大,而x增大,Co2+的比例增大,所以Co2+的催化效果更好;
(2)①由题意知,二水合草酸钴(CoC2O4·2H2O)的起始质量是18.3g,物质的量是0.1mol,其中Co元素的质量是5.9g,300℃时该固体分解为Co的氧化物,C点固体质量是8.03g,则O元素的质量是8.03g-5.9g=2.13g,物质的量是2.13g/16g/mol=0.133125mol,则该固体中Co与O原子的物质的量之比是0.1:0.133125=3:4,所以C点对应固体的化学式是Co3O4;B点对应的物质的质量是14.70g,与 起始的固体质量相比减少18.3-14.7=3.6g,恰好为结晶水的质量,所以B点对应的物质是草酸钴,与O2在225℃~300℃发生反应生成Co3O4和二氧化碳,所以反应的化学方程式是3CoC2O4 + 2O2 = Co3O4 +6CO2;
②设该钴的氧化物中+3价Co的原子个数是x,与盐酸反应得到的黄绿色气体为氯气,物质的量是4.48L/22.4L/mol=0.2mol,则反应中失去电子的物质的量是0.4mol,Co最终都变为+2价,则+3价Co得到电子的物质的量是x=0.4,480 mL 5 mol/L盐酸中氯离子的物质的量是0.48L×5mol/L=2.4mol,被氧化的氯离子的物质的量是0.4mol,所以溶液中还余氯离子的物质的量是2.4-0.4=2.0mol,根据Cl元素守恒,所以CoCl2的物质的量是1.0mol,则钴的氧化物中+2价钴的物质的量是1.0-0.4=0.6mol,根据正负化合价的代数和为0,则钴的氧化物中O元素的物质的量是(0.4mol×3+0.6mol×2)/2=1.2mol,所以该钴氧化物中Co、O的物质的量之比为1.0:1.2=5:6.
考点:考查元素化合价的判断,物质化学式的计算,得失电子守恒规律的应用
本题难度:困难
5、选择题 下列变化中需加入氧化剂才能实现的是(?)。
A.Cl-→Cl2
B.Fe3+→Fe2+
C.CuO→Cu
D.H2SO4→BaSO4
参考答案:A
本题解析:A选项氯由负一价到零价,化合价升高,被氧化。故需要加入氧化剂。B选项化合价降低,被还原,需加入还原剂。C选项,化合价降低,需加入还原剂。D选项非氧化还原反应。
本题难度:简单