1、填空题 已知甲烷的燃烧热为890.3 kJ/mol请完成表示甲烷燃烧熟的热化学方程式
2、填空题 (8分)25OC时,0.1 mol/LHCl溶液中,[Cl-] =__________,[ OH-] =___________,Kw=______________;
若向15mL此溶液中加入15mL 0.3 mol/L NaOH溶液,则混合液pH=________。
3、选择题 室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是
A.实验过程中水的电离程度的变化是先减小后增大
B.当溶液呈中性时,反应恰好完全
C.当反应恰好完全时,消耗NaOH溶液10mL
D.当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+)
4、选择题 2008年北京奥运会“祥云”火炬用的是环保型燃料——丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为: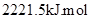 -1,下列有关说法正确的是(?)
-1,下列有关说法正确的是(?)
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ/mol
5、选择题 白磷(P4)在空气中燃烧可以生成六氧化四磷(P4O6)和十氧化四磷(P4O10),其中生成六氧化四磷的热化学方程式为:P4(s)+3O2(g)=P4O6(s) △H=-1 638 kJ·mol-1。下列说法中正确的是
[?]
A.1 mol P4O6(s)的总能量大于1 mol P4(s)和3 mol O2(g)的能量之和
B.自磷(P4)的燃烧热为1 638 kJ.mol-1
C.白磷(P4)在空气中燃烧为放热反应,利用此性质可制得安全火柴
D.白磷燃烧生成P4O10的热化学方程式为P4 (s)+5O2(g)=P4O10(s) △H<-1 638 kJ·mol-1