1、填空题 黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式???。K4[Fe(CN)6] ?中Fe2+与CN-之间的作用力是???。
(2)CN-中碳原子的杂化方式为???;1molCN-中含有π键的数目为???。
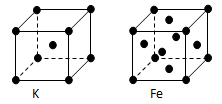
(3)金属钾、铁的晶体的晶胞结构如下图,钾、铁两种晶体晶胞中金属原子的配位数之比为???。
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为???。
参考答案:(12分)?
(1)1s22s22p63s23p63d6或[Ar]3d6?(2分)?配位键(2分)
(2)sp杂化(2分)? 2NA个(2分)
(3)2:3(2分)
(4) K4Fe(CN)6 + 6H2SO4 + 6H2O 2K2SO4 + FeSO4+3(NH4)2 SO4+6CO↑(2分)
2K2SO4 + FeSO4+3(NH4)2 SO4+6CO↑(2分)
本题解析:(1)铁是26号元素核外电子的排布式为1s22s22p63s23p63d6或[Ar]3d6,K4[Fe(CN)6]是配合物,Fe2+是中心原子,CN-是配位原子Fe2+与CN-之间的作用力是配位键。
(2)CN-中含有碳氮三键,是直线型,碳原子的杂化方式为sp杂化。一个CN-中含有两个π键,所以1molCN-中含有π键的数目是2NA个。
(3)根据晶胞的结构可以确定钾金属中钾原子的配位数为8,铁原子的配位数为12,所以配位数之比为2:3。
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应所以反应前后各元素的化合价均不发生变化,与CN-是等电子体的气态化合物常见的是一氧化碳,所以反应的化学方程式为
K4Fe(CN)6 + 6H2SO4 + 6H2O 2K2SO4 + FeSO4+3(NH4)2 SO4+6CO↑
2K2SO4 + FeSO4+3(NH4)2 SO4+6CO↑
本题难度:一般
2、选择题 下列与H2O分子空间构型不相同的是
[? ]
A.H2S
B.NH3
C.H2Se
D.CO2
参考答案:BD
本题解析:
本题难度:简单
3、选择题 用价层电子对互斥理论预测SO2和NO3-的立体结构,两个结论都正确的是?
[? ]
A.直线形;三角锥形?
B.V形;三角锥形
C.直线形;平面三角形?
D.V形;平面三角形
参考答案:D
本题解析:
本题难度:简单
4、简答题 下列是部分金属元素的电离能
| X | Y | Z
第一电离能(kJ/mol)
520.2
495.8
418.8
|
(1)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为______.
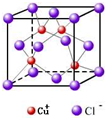
(2)CuCl用作有机合成催化剂,并用于颜料,防腐等工业.CuCl的晶体结构如图所示.元素Cu基态原子的电子排布式______,与同一个Cl-相连的Cu+有______个.
参考答案:(1)X、Y、Z的价层电子构型为ns1,则这三种元素都属于第IA族元素,同一主族元素,元素的第一电离能随着原子序数的增大而减小,根据表格知,X、Y、Z这三种元素的金属性逐渐增强,原子半径逐渐增大,这三种金属的氯化物(RCl)都是离子晶体,离子晶体的熔点与离子半径成反比,与电荷数成正比,X、Y、Z这三种阳离子电荷数相等,离子半径逐渐增大,所以其熔点从小到大的顺序是ZCl<YCl<XCl,故答案为:ZCl<YCl<XCl;
(2)铜是29号元素,其原子核外有29个电子,根据构造原理知其基态原子核外电子排布式为:[Ar]3d104s1,根据晶胞结构知,面心上的氯离子连接4个亚铜离子,
故答案为:[Ar]3d104s1,4.
本题解析:
本题难度:简单
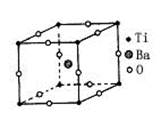
5、选择题 钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构如图所示,它的化学式是?(?)
A.BaTi8O12
B.BaTi4O6
C.BaTi?2O4
D.BaTiO3
参考答案:D
本题解析:结合识图考查晶体结构知识及空间想象能力。解题关键:由一个晶胞想象出在整个晶体中,每个原子为几个晶胞共用是解题的关键。Ba在立方体的中心,完全属于该晶胞; Ti原子处于立方体的顶点上,为8个晶格共用,O原子处于立方体的12条棱的中点,每条棱为4个立方体共用,故每个O原子只有1/4属于该晶胞。故晶体的化学式为BaTiO3。
本题难度:一般