1、选择题 下列各组物质中,按熔点由低到高排列正确的是(?)
A.O2、I2、Hg
B.CO2、KCl、SiO2
C.HF、HCl、HI
D.SiO2、NaCl、SO2
参考答案:B
本题解析:A、Hg常温下为液态,所以三者的熔点由低到高排列O2、Hg、I2,错误;B、CO2属于分子晶体,熔点最低,KCl属于离子晶体,熔点低于原子晶体,SiO2属于原子晶体,熔点最高,正确;C、HF分子间存在氢键,熔点最高,错误;D、SiO2属于原子晶体,熔点最高,错误,答案选B。
本题难度:一般
2、选择题 2011年诺贝尔化学奖授予以色列科学家达尼埃尔·谢赫特曼,以表彰他发现了准晶体。准晶体材料具有硬度高,不易损伤,使用寿命长等特点。下列叙述错误的是(?)
A.自然界中的固体可分为晶体、准晶体和非晶态物质
B.准晶体是一种介于晶体和非晶态物质之间的固体
C.准晶体材料的应用具有较大的发展空间
D.化学式为Al63Cu24Fe13的准晶体不可与稀硝酸发生反应
参考答案:D
本题解析:A、固体有晶体、非晶体之分,介于晶体、非晶体之间的为准晶体,正确;B、准晶体介于晶体和非晶态物质之间,具有晶体和非晶体的性质,正确;C、准晶体硬度高,不易损伤,使用寿命长,具有较大发展空间,正确;D、Al63Cu24Fe13的准晶体所含元素都能与稀硝酸反应,错误。
本题难度:一般
3、选择题 在下列四种有关性质的叙述中,可能属于金属晶体的是(? )
A.由分子间作用力结合而成,熔点低
B.固体或熔融后易导电,熔点在1000℃左右
C.由共价键结合成网状结构,熔点高
D.固体不导电,但溶于水或熔融后能导电
参考答案:B
本题解析:A为分子晶体;B中固体能导电,熔点在1000℃左右,不是很高,应为金属晶体;C为原子晶体;D为离子晶体。
本题难度:一般
4、选择题 下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( ? )
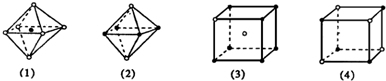
A.图(1)和图(3)
B.图(2)和图(3)
C.图(1)和图(4)
D.只有图(4)
参考答案:C
本题解析:
本题难度:简单
5、填空题 ?【化学――选修物质结构与性质】(15分)
有A、B、C、D、E五种元素。其相关信息如下:

请回答下列问题。
(1) 写出E元素原子基态时的电子排布式__________________;
(2) C元素的第一电离能比氧元索的第一电离能 ______ ______ (填“大”或“小”);
(3) CA3分子中C原子的杂化轨道类型是____________;
(4) A、C、E三种元素可形成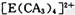 配离子,其中存在的化学键类型有 ______ (填序号);
配离子,其中存在的化学键类型有 ______ (填序号);
①配位键 ②金属键③极性共价键④非极性共价键⑤离子键 ⑥氢键
若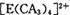 具有对称的空间构型,且当
具有对称的空间构型,且当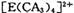 中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则
中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则 的空间构型为 ____________ (填序号);
的空间构型为 ____________ (填序号);
a.平面正方形b.正四面体c.三角锥型 ?d. V型
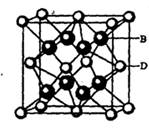
(5) B与D可形成离子化合物,其晶胞结构如右图所示。其中D离子的配位数为_____,若该晶体的密度为ag ? cm-3,则该晶胞的体积是______cm-3(写出表达式即可)。
参考答案:(1) 1s2 2s2 2p6 3s2 3p6 3d10 4s1或[Ar] 3d10 4s1(2)大(3)sp3(4)①③;a (5) 8;(4×78/ NAa) cm3.
本题解析:本题考查物质结构与性质的有关知识。根据A、B、C、D、E五种元素的相关信息,可以推断出A、B、C、D、E五种元素分别是H、F、N、Ca、Cu。(1) Cu的基态电子排布式为1s2 2s2 2p6 3s2 3p6 3d10 4s1或[Ar] 3d10 4s1(2)由于N的P电子满足洪特规则,能量降低,第一电离能升高,故N元素的第一电离能比氧元索的第一电离能大。(3)NH3中氮原子最外层有5个电子,与氢共用3个电子,达8电子结构。根据价层电子对互斥理论,四对电子的排布方式为四面体构形,根据杂化轨道理论,应为sp3杂化。(4)[Cu(NH3)4]2+中Cu与NH3通过配位键结合,NH3中N与H通过极性共价键结合。由于[Cu(NH3)4]2+是对称结构,且两个NH3被两个Cl-取代时,能得到两种不同结构的产物。如果[Cu(NH3)4]2+是正四面体结构,两个NH3被两个Cl-取代时,能得到一种产物,不合题意,故[Cu(NH3)4]2+是平面正方形结构。(5)F与Ca形成CaF2,从晶体结构可以看出,氟化钙结构又称萤石型结构,属等轴晶系,面心立方结构。氟化钙是AB2型离子晶体。其中阳离子A(Ca2+)呈立方密堆积,阴离子B(F-)填充在四面体空隙中,面心立方点阵对角线的1/4和3/4处。阴、阳离子的配位数分别为4和8。阳、阴离子半径比R2+/R->0.732。,所以一个氟化钙晶体中有4个氟化钙。该晶体的密度为ag ? cm-3,则该晶胞的体积是(4×78/ NAa) cm3。
本题难度:一般