|
高考化学必考知识点《与量有关的离子方程式的书写》试题预测(2019年最新版)(四)
2020-07-07 23:54:58
【 大 中 小】
|
1、选择题 下列离子方程式正确的是?(?)
A.氯气通入水中: Cl2+H2O=2H++ Cl-+ ClO-
B.过量的氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
C.次氯酸钠溶液中加入少量硫酸亚铁溶液:Fe2++2ClO-+H2O=Fe(OH)2↓+2HClO
D.NaHCO3溶液与过量Ba(OH)2溶液混合:
| 2HCO3-+2OH-+Ba2+= BaCO3↓+CO32-+2H2O
参考答案:B
本题解析:
A.不正确, Cl2+H2O=H++ Cl-+ HClO
B.正确;
C.不正确, ClO―将Fe2+ 氧化;
D.不正确,
HCO3-+OH-+Ba2+= BaCO3↓+H2O
本题难度:一般
2、填空题 物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):
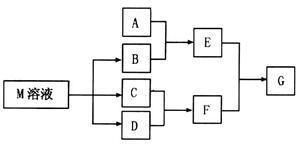
(1)写出用惰性电极电解M溶液的离子方程式?。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是?。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是?。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是?。
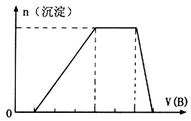
(5)若A是一种溶液,只可能含有 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为?。 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为?。
参考答案:(1)2Cl?+2H2O 2OH?+H2↑+Cl2↑(2分) 2OH?+H2↑+Cl2↑(2分)
(2)H2SiO3(1分)
(3)溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失(1分)
(4)4Fe2++8OH?+O2 +2H2O = 4Fe(OH)3↓(2分)
(5)c(H+):c(Al3+):c(NH4+):c(SO42?)=1:1:2:3(2分,推断出前三种且结果正确得1分)
本题解析:C可在D中燃烧发出苍白色火焰,可知二者分别为H2、Cl2,F为HCl,物质M是一种日常生活中不可缺少的调味品,为NaCl,则B为NaOH 。
(1)用惰性电极电解NaCl溶液,生成NaOH、H2、Cl2,离子方程式为:
2Cl?+2H2O 2OH?+H2↑+Cl2↑ 2OH?+H2↑+Cl2↑
(2)若A是一种酸性氧化物,且可用于制造玻璃,则A为SiO2,与NaOH反应生成的E为Na2SiO3,与HCl反应生成的G为H2SiO3。
(3)A是一种常见金属单质,能与NaOH溶液反应,则A为Al,E为Na[Al(OH)4],将过量的盐酸逐滴加入Na[Al(OH)4]溶液,边加边振荡,Na[Al(OH)4]先与HCl反应生成Al(OH)3,继续加入HCl,Al(OH)3与HCl反应生成AlCl3,所以实验现象为:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。
(4)A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A中含Fe2+,生成的E为Fe(OH)3,发生的反应有:Fe2++2OH?=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,两步反应加和可得离子方程式:4Fe2++8OH?+O2 +2H2O = 4Fe(OH)3↓
(5)根据图像,设图像中加入单位体积的NaOH溶液含NaOH为1mol,加入第一部分NaOH没有沉淀生成,发生的反应为:OH?+H+=H2O,则原溶液含H+,物质的量为1mol;继续加入3mol NaOH生成沉淀,最后加入1mol NaOH,Al(OH)3溶解,则原溶液含Al3+,物质的量为1mol;则Mg2+、Fe3+、CO32?一定不存在;中间加入2mol NaOH,沉淀不变,发生的反应为OH?与NH4+反应,则原溶液含NH4+,物质的量为2mol,阴离子只能为SO42?,根据电荷守恒可得SO42?的物质的量为3mol,所以c(H+):c(Al3+):c(NH4+):c(SO42?)=1:1:2:3
本题难度:困难
3、填空题 将HCl、H2SO4、Ba(NO3)2三种溶液,按一定顺序滴入到Na2CO3溶液中至恰好完全反应,有以下现象:
①加入A时生成白色沉淀;
②往①中沉淀加入B时沉淀溶解,并有气体逸出;
③往②中生成的溶液中加入C时,又有白色沉淀生成.
根据上述现象,回答:
(1)A、B各是什么溶液?(填化学式)A:______?B:______
(2)分别写出各反应的离子方程式:①______;②______;③______.
参考答案:①加入A时生成白色沉淀,三种溶液中只有钡离子能和碳酸根离子反应生成白色沉淀,所以A是硝酸钡,②往①中沉淀加入B时沉淀溶解,并有气体逸出,③往②中生成的溶液中加入C时,又有白色沉淀生成,硫酸和碳酸钡反应生成硫酸钡和二氧化碳,盐酸和碳酸钡反应只有气体生成,所以B是盐酸,C是硫酸.
(1)通过以上分析知,A是?Ba(NO3)2 B是HCl,故答案为:Ba(NO3)2;HCl;
(2)①钡离子和碳酸根离子反应生成碳酸钡白色沉淀,离子方程式为Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓;
②碳酸钡和盐酸反应生成钡离子、二氧化碳和水,离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
③钡离子和硫酸根离子反应生成硫酸钡白色沉淀,离子方程式为:Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓.
本题解析:
本题难度:一般
4、选择题 化学中常借助曲线图来表示某种变化过程,有人分别画出了下列的四个曲线图:
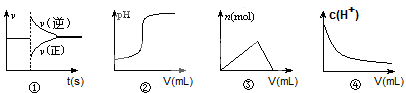
有关上述曲线图的说法正确的是:
A.曲线图①可以表示恒压容器中某化学平衡体系充入气体生成物后反应速率随时间的变化
B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的盐酸时的pH的变化
C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时的产生沉淀的物质的量变化
D.曲线图④可以表示冰醋酸加水稀释过程中溶液中c(H+)的变化
参考答案:A
本题解析:A、恒压条件下,充入气体生成物,生成物浓度增大,反应物浓度减小,平衡左移,故A正确;B、向一定量的氢氧化钠溶液中滴加一定浓度的盐酸时pH应该减小,错误;C、向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时,先产生沉淀,后沉淀会溶解一部分,但不会完全消失,错误;D、冰醋酸加水稀释过程中溶液中c(H+)先增大后减小,错误。
本题难度:一般
5、选择题 以下化学反应的离子方程式书写正确的是
A.硫酸与氢氧化钡溶液反应:H++OH-=H20
B.碳酸钙与盐酸反应:CO32-+2H+= H2O+C02↑
C.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
D.氯气与溴化钠溶液反应:C12+2Br-=Br2+2Cl-
参考答案:D
本题解析:A中还有硫酸钡生成,A不正确;B中碳酸钙是难溶性物质,应该用化学式表示;C中电子的得失不守恒,所以正确的答案选D。
点评:归判断离子方程式正确与否的方法一般是:(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式。
本题难度:一般
|