1、选择题 下列反应的离子方程式正确的是( )
A.向澄清石灰水滴加稀硫酸:2H++SO42-+Ca(OH)2=2H2O+CaSO4↓
B.硫化亚铁与溶于稀硝酸:FeS+2H+=Fe2++H2S↑
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
参考答案:A、向澄清石灰水滴加稀硫酸:2H++SO42-+Ca2++2OH-=2H2O+CaSO4↓,故A错误;
B、硫化亚铁与溶于稀硝酸,硝酸能氧化硫化亚铁为三价铁和硫单质;,故B错误;
C、氢氧化铝中和胃酸反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,故C正确;
D、小苏打与氢氧化钠溶液混合的离子方程式为:HCO3-+OH-=CO32-+H2O,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 下列离子方程式书写正确的是
A.NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2 = 4SO32―+O2↑+ 4Na+
B.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+) = 7∶2时,2Al3+ + 7OH-= Al(OH)3↓+ AlO2- + 2H2O
C.Cl2与FeBr2溶液反应,当n(Cl2)∶n(FeBr2) = 1∶1时,2Fe2++ 4Br-+3Cl2 =" 2" Fe3++ 2Br2 + 6Cl-
D.向次氯酸钙溶液通入过量CO2:Ca2++ 2ClO一+ CO2 + H2O = CaCO3↓+ 2HclO
参考答案:B
本题解析:HSO3-具有还原性,Na2O2具有氧化性,二者发生氧化还原反应,A错误;Al3+与OH-物质的量比1:3时生成氢氧化铝、物质的量比1:4时生成AlO2-,题中n(Al3+):n(AlO2-)=2:7,介于1:4与1:3之间,所以同时生成Al(OH)3和AlO2-,B正确;Cl2与FeBr2等物质的量反应时,Cl2、Fe2+、Br-物质的量比为1:1:1,C错误;次氯酸钙溶液中通入过量二氧化碳气体,无碳酸钙沉淀生成,D错误。
点评:氯气与溴化亚铁溶液反应时,由于还原性Fe2+>Br-,所以氯气先氧化Fe2+、后氧化Br-,设Cl2和FeBr2均为1mol,1molCl2氧化1molFe2+、1molBr-,参加反应的三者物质的量相等。
本题难度:一般
3、选择题 可用H++OH-=H2O表示的化学反应是( )
A.H2SO4+Ba(OH)2-
B.CH3COOH+Fe(OH)3-
C.NaHCO3+KOH-
D.HCl+NaOH-
参考答案:A.H2SO4+Ba(OH)2-的离子反应为2H++2OH-+Ba2++SO42-=BaSO4↓+2H2O,故A不选;
B.CH3COOH+Fe(OH)3-的离子反应为3CH3COOH+Fe(OH)3=Fe3++3CH3COO-+3H2O,故B不选;
C.NaHCO3+KOH-的离子反应为HCO3-+OH-=CO32-+H2O,故C不选;
D.HCl+NaOH-的离子反应为H++OH-=H2O,故D选;
故选D.
本题解析:
本题难度:一般
4、选择题 下列离子方程式书写正确的是
A.向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-="==" CaCO3↓+CO32-+2H2O
B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-===2I2+2H2O
C.次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O=2HClO+SO32-
D.硫化钠的水解反应:S2-+H3O+ HS-+H2O
HS-+H2O
参考答案:B
本题解析:A中的氨水是难电离的,应该用化学式表示,A不正确;C中次氯酸钠具有氧化性,能把SO2氧化生成硫酸,C不正确;D不正确,水解反应方程式应该是S2-+H2O HS-+OH-,答案选B。
HS-+OH-,答案选B。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:一般
5、简答题 向20mL5mol/L的AlCl3溶液中滴入2.5mol/LNaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:
(1)图中a点表示的意义是______.图中b点表示的意义是______.
(2)写出滴入NaOH溶液至b点整个过程反应的离子方程式:______.
(3)若溶液中产生沉淀3.9g,则消耗NaOH溶液的体积可能为______.
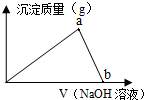
参考答案:(1)根据图示可知,图中随着加入氢氧化钠溶液逐渐增多,生成的氢氧化铝沉淀质量逐渐增大,到达a点时沉淀达到最大;从a点之后,生成的氢氧化铝沉淀逐渐溶解,在图中b点氢氧化铝完全溶解,
故答案为:Al3+完全沉淀;Al(OH)3刚好完全溶解;
(2)把NaOH溶液滴入AlCl3溶液中,先产生Al(OH)3沉淀,反应的离子方程式为:Al3++3OH-=Al(OH)3↓,到达a点后氢氧化铝逐渐溶解,反应的离子方程式为:Al(OH)3+OH-=AlO2-+H2O,
故答案为:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+H2O;
(3)3.9g氢氧化铝的物质的量为:3.9g78g/mol=0.05mol;当有3.9 g Al(OH)3沉淀生成时,根据图象可知,存在两种情况:
①AlCl3过量,加入NaOH使Al3+部分产生沉淀3.9 g,根据反应Al3++3OH-=Al(OH)3↓可知消耗氢氧化钠的物质的量为:0.05×3=0.15mol,需要氢氧化钠溶液的体积为:0.15mol2.5mol/L=0.06L=60mL;
②当NaOH过量使Al3+全部参加反应生成Al(OH)3沉淀后又部分溶解,根据反应Al3++3OH-=Al(OH)3↓,氯化铝离子完全生成氢氧化铝需要氢氧化钠溶液的体积为:5mol/L×0.02L×32.5mol/L=0.12L=120mL;氢氧化铝沉淀的总物质的量为:n(Al(OH)3)=n(AlCl3)=0.02L×5mol/L=0.1mol,剩余0.05mol氢氧化铝,说明溶解的氢氧化铝的物质的量为:0.1mol-0.005mol=0.05mol,根据反应Al(OH)3+OH-=AlO2-+H2O,需要消耗氢氧化钠的物质的量为:n( NaOH)=n(Al(OH)3)=0.05mol,需要2.5mol/L NaOH溶液的体积为:0.05mol2.5mol/L=0.02L=20mL,总共消耗氢氧化钠溶液的体积为:120mL+20mL=140mL,
故答案为:60 mL或140mL.
本题解析:
本题难度:一般