1、简答题 一定质量的甲烷燃烧后得到的产物为一氧化碳、二氧化碳和水蒸气,此混合气体的总质量为49.6g.当混合气体缓慢通过足量的浓硫酸时,浓硫酸的质量增加了25.2g.求:
(1)燃烧的甲烷的物质的量.______
(2)产物混合体体中含二氧化碳的质量.______
(3)若使此甲烷充分燃烧,还需要标准状况下的氧气的体积.______.
参考答案:(1)产物通过浓硫酸时,浓硫酸增重25.2g为水的质量,所以n(H2O)=25.2g18g/mol=1.4mol,n(H)=2n(H2O)=2.8mol,根据H原子守恒,可知:n(CH4)=14n(H)=14×2.8mol=0.7mol,故答案为:0.7mol;
(2)n(CH4)=0.7mol,根据C原子守恒则n(CO)+n(CO2)=0.7mol,且m(CO)+m(CO2)=49.6g-25.2g=24.4g
所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,解之:n(CO2)=0.3mol,所以二氧化碳的质量为0.3mol×44g/mol=13.2g.
故答案为:13.2g;
(3)甲烷不完全燃烧生成的一氧化碳的物质的量是0.7mol-0.3mol=0.4moL,这些一氧化碳完全燃烧会消耗氧气的物质的量是0.2mol,体积是0.2mol×22.4L/mol=4.48L.
故答案为:4.48L.
本题解析:
本题难度:一般
2、计算题 (8分)金属X和非金属Y可:直接化合生成化合物XY,甲、乙、丙三人分别做X和Y的化合反应实验,充分反应时,每人所用X和Y的质量各不相同,但总质量均为12g,有关实验数据如下表示:
?
| X用量
| Y用量
| 得XY量
|
甲
| 10g
| 2g
| 8g
|
乙
| 6g
| 6g
| 8g
|
(1)利用表中数据判定X和Y恰好完全反应时,X和Y的质量比为:________ 。
(2)若丙同学在实验中只得到6gXY,试通过计算说明丙同学X和Y的用量分别是多少?
参考答案:(1)3∶1
(2)若X过量,m(X)=10.5g? ,m(Y)=1.5g;?若Y过量,m(X)=4.5g? m(Y)=7.5g
本题解析:(1)根据甲乙的数据对比可知,6gX和2gY恰好反应,因此质量之比是3∶1。
(2)根据题意可知,X和Y一定有过量的。所以如果X过量,则需要Y是2g×6、8=1.5g,因此m(X)=12g-1.5g=10.5g ;如果Y过量,则需要X是6g×6/8=4.5g,所以m(Y)=12g-4.5g=7.5g。
本题难度:一般
3、选择题 实现下列反应需加入氧化剂的是
A.NaOH → NaCl
B.H2SO4 → H2
C.HCl → Cl2
D.CaCO3 → CO2
参考答案:C
本题解析:略
本题难度:简单
4、选择题 2011年是国际化学年。下列有关化学用语使用不正确的是 ?(?)
A.硫离子的结构示意图:
B.CCL4的电子式: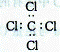
C.质量数为14的氮原子:14N
D.淀粉的分子式:(C6H10O5)n
参考答案:B
本题解析:略
本题难度:简单
5、填空题 实验室中所用少量氯气是用下列方法制取的:
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(1)该反应既是离子反应也是氧化还原反应。该反应的还原剂是 (用化学式表示)。
氯气有毒会污染空气,实验室常用氢氧化钠吸收该实验的尾气,写出用氢氧化钠溶液吸收氯气的离子方程式 。
(2)若有17.4gMnO2与足量的浓盐酸充分反应后, 所得溶液的体积为500 mL,求:
①转移电子数为______ _;
②被氧化的HCl的物质的量_______ mol;
参考答案:(1)HCl Cl2+2 OH-=Cl-+ClO-+H2O (2)①0.4 NA ② 0.4
本题解析:(1)在反应4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O中,氯元素的化合价从-1价升高到0价,失去电子,被氧化,因此氯化氢是还原剂。Mn元素的化合价从+4价降低到+2价,得到电子,被还原,所以二氧化锰是氧化剂。氯气有毒,需要尾气处理,氢氧化钠溶液能吸收氯气,反应的离子方程式为Cl2+2 OH-=Cl-+ ClO-+H2O。
Cl2↑+MnCl2+2H2O中,氯元素的化合价从-1价升高到0价,失去电子,被氧化,因此氯化氢是还原剂。Mn元素的化合价从+4价降低到+2价,得到电子,被还原,所以二氧化锰是氧化剂。氯气有毒,需要尾气处理,氢氧化钠溶液能吸收氯气,反应的离子方程式为Cl2+2 OH-=Cl-+ ClO-+H2O。
(2)①隔绝n=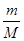 可知,17.4gMnO2的物质的量=17.4g÷87g/mol=0.2mol。在反应中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以0.2mol二氧化锰得到0.4mol电子,因此转移电子的个数是0.4 NA。
可知,17.4gMnO2的物质的量=17.4g÷87g/mol=0.2mol。在反应中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以0.2mol二氧化锰得到0.4mol电子,因此转移电子的个数是0.4 NA。
②1mol氯化氢在反应中失去1mol电子,所以0.2mol二氧化锰能氧化氯化氢的物质的量是0.4mol。
考点:考查氧化还原反应的有关判断和计算
本题难度:一般