1、填空题 向20mL盐酸和硫酸的混合酸溶液中,渐渐加入
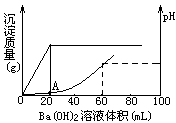
0.1mol/L的Ba(OH)2溶液。生成沉淀的质量和溶液的pH变化曲线如右图。根据此实验数据计算:
 ?
?
(1)原溶液中硫酸和盐酸的浓度各为多少_________________。
(2)A点处溶液的pH是______________。
参考答案:(1)c(H2SO4)="0.1mol/L?" c(HCl)="0.4mol/L?"
(2) pH=0.7
本题解析:本题以图示形式检查酸、碱中和生成沉淀质量和溶液pH曲线随加入Ba(OH)2溶液体积变化情况,此题属于理解层次的中等难度试题。
(1)依据图示,沉淀最大时已加入Ba(OH)2溶液20mL,混合酸中硫酸被完全中和。所以原混合酸中硫酸的物质的量浓度为0.1mol/L。
当H2SO4刚被Ba(OH)2溶液中和时,可以认为溶液中盐酸未被中和。从20mL起,再加Ba(OH)2溶液至60mL时溶液中盐酸全被中和完,溶液呈中性,pH=7,所以原混合酸中盐酸的物质的量浓度为0.4mol/L。
(2)A点处溶液中氢离子浓度是盐酸提供的,因H2SO4刚被Ba(OH)2溶液中和,溶液被冲稀,体积扩大到原来的2倍,则盐酸浓度缩小到原来的1/2,由原来的0.4mol/L变为0.2mol/L。即氢离子浓度为0.2mol/L。所以pH=0.7。
本题难度:简单
2、实验题 实验室用下述装置制取氯气,并用氯气进行下列实验。 回答下列问题:
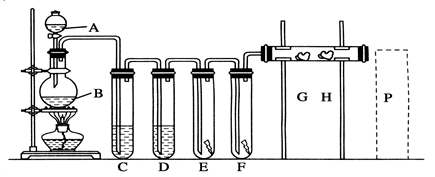
(1)A、B两仪器的名称:A_________________,B________________。
(2)洗气装置C是为了除去Cl2中的HCl气体,应放入的试剂是________________,D中浓H2SO4的作用是________________。
(3)E中为红色干布条,F中为红色湿布条,可看到有色布条褪色的是 _______。(填E或F)
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______________。
H是浸有NaBr溶液的棉花球,H处反应的离子方程式是___________________________________________。
(5)P处为尾气吸收装置, 写出实验室利用烧碱溶液吸取Cl2的离子方程式: ___________________。
(6)B中发生反应的化学方程式为_______________________ ,若实验中使用12 mol·L-1的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,试分析可能存在的原因是______________________________________________________。
参考答案:(1)分液漏斗 圆底烧瓶? (2)饱和食盐水 除去氯气中的水蒸气
(3)F ?(4)蓝色? 2 Br-+Cl2=2Cl-+Br 2
(5)Cl2+2OH-=Cl-+ClO-+H2O?
(6)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应。
MnCl2+Cl2↑+2H2O随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应。
本题解析:(1)由装置图示可知:A是分液漏斗;B是圆底烧瓶。(2)用浓HCl与MnO2在加热条件下发生反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O制取氯气。由于浓盐酸有挥发性,所以在氯气中含有杂质HCl。由于氯气在饱和食盐水中的溶解度小,所以为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水。此时产生的氯气中任然含有水蒸气。用浓硫酸来干燥。因此D中浓H2SO4的作用是除去氯气中的水蒸气。(3)氯气没有漂白性,当氯气遇水时二者发生反应产生HClO,有漂白性。因此E中红色干布条不褪色,F中红色湿布条褪色。(4)G是浸有淀粉KI溶液的棉花球,氯气会与KI发生反应:2 I-+Cl2=2Cl-+I 2,I 2遇淀粉变为蓝色。因此G处现象是棉花球表面变成蓝色。H是浸有NaBr溶液的棉花球,由于活动性Cl2>Br 2。所以H处反应的离子方程式是2 Br-+Cl2=2Cl-+Br 2。(5)氯气是大气污染物,所以在排放前应该进行尾气处理。由于氯气能与碱发生反应,所以若P处为尾气吸收装置,实验室利用烧碱溶液吸取Cl2的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O。(6)在B中发生的实验室制取氯气的反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O制取氯气。由于浓盐酸有挥发性,所以在氯气中含有杂质HCl。由于氯气在饱和食盐水中的溶解度小,所以为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水。此时产生的氯气中任然含有水蒸气。用浓硫酸来干燥。因此D中浓H2SO4的作用是除去氯气中的水蒸气。(3)氯气没有漂白性,当氯气遇水时二者发生反应产生HClO,有漂白性。因此E中红色干布条不褪色,F中红色湿布条褪色。(4)G是浸有淀粉KI溶液的棉花球,氯气会与KI发生反应:2 I-+Cl2=2Cl-+I 2,I 2遇淀粉变为蓝色。因此G处现象是棉花球表面变成蓝色。H是浸有NaBr溶液的棉花球,由于活动性Cl2>Br 2。所以H处反应的离子方程式是2 Br-+Cl2=2Cl-+Br 2。(5)氯气是大气污染物,所以在排放前应该进行尾气处理。由于氯气能与碱发生反应,所以若P处为尾气吸收装置,实验室利用烧碱溶液吸取Cl2的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O。(6)在B中发生的实验室制取氯气的反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。若实验中使用12 mol/L的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,是因为随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应。
MnCl2+Cl2↑+2H2O。若实验中使用12 mol/L的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,是因为随着反应的进行,消耗氯化氢,同时生成水,且氯化氢挥发,使盐酸的浓度逐渐减小,稀盐酸与二氧化锰不反应。
本题难度:一般
3、选择题 如图所示,A处通入Cl2,打开B阀时,C处红色布条无变化;关闭B阀时,C处红色布条褪色,则D中的溶液是( )
A.饱和食盐水
B.KI溶液
C.NaOH溶液
D.浓H2SO4