|
高考化学知识点总结《氯及其化合物》高频考点预测(2019年最新版)(十)
2020-07-07 23:57:04
【 大 中 小】
|
1、填空题 盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有?性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有?性,实验室不能用浓硫酸干燥氨气,说明硫酸具有?性。
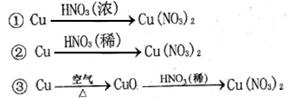
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是?(填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是?。
A.40.32 L
B.30.24 L
C.20.16 L
D.13.44 L
| ②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 ??。
(4) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,则反应的化学方程式为??。
参考答案:
(1)强氧化性?,?脱水性 , 酸性
(2)③?
(3)①? D?②? 3Cu+2NO3-+8H+= 3Cu2+ +2NO+4H2O?
(4)Cu+2HCl+H2O2=CuCl2+2H2O
本题解析:(2)绿色化学的理念就是没有污染或污染很少,①②均产生污染性氮氧化物气体,③中不产生。(3)与金属反应的浓硫酸一半作为氧化剂被还原为二氧化硫,但随反应进行硫酸浓度降低到一定程度会不与金属铜反应,故反应产生气体的量要小于20.16L。在加入硝酸钠,硝酸根离子在酸性条件下氧化铜,双氧水也是这个作用。
本题难度:一般
2、选择题 下面有关氯气的叙述正确的是( )
A.氯气可使湿润的红布条退色,所以氯气具有漂白性
B.在通常情况下,氯气可以和任何金属直接化合
C.氯气没有漂白性,但通入品红溶液中,品红会退色
D.氯气是黄绿色气体,闻其气味时要小心将集气瓶放在鼻孔下直接闻
参考答案:C
本题解析:A 错误,氯气可使湿润的红布条退色,是因为有次氯酸的缘故,氯气不具有漂白性
B 错误,在点燃的情况下,氯气可以和大多数金属直接化合
C 正确,氯气溶于水,生成了次氯酸,可以使品红褪色
D 错误,闻氯气味时,用手轻轻煽动瓶口,让极少量的气体飘入鼻孔。
本题难度:简单
3、选择题 生活中的某些问题,常涉及到化学知识,下列分析不正确的( )
A.冰箱中使用的含氟制冷剂泄漏后,会破坏臭氧层
B.Cl2和SO2都有漂白作用,都可以使有色棉布褪色
C.减少硫的氧化物和氮氧化物向空气中的排放,是防止酸雨形成的有效措施
D.严格地讲实验室使用排风扇是种不负责任的防污染手段,因为产生的有害气体没有得到转化或吸收
参考答案:A.臭氧层在氟氯代烃的催化作用下可转化为氧气,破坏臭氧层,应减少使用,故A正确;
B.干燥的氯气不具有漂白性,不能使有色布条褪色,故B错误;
C.硫的氧化物和氮氧化物可导致酸雨,应减少硫的氧化物和氮氧化物向空气中的排放,故C正确;
D.实验室使用排风扇,可减少实验室污染,但没有使有害气体转化和吸收,是一种不负责任的做法,故D正确.
故选B.
本题解析:
本题难度:简单
4、实验题 在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
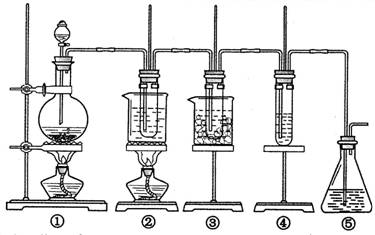
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为?。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:?
A.NaBiO3? B.FeCl3? C.PbO2?
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>FeCl3
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①?;②?。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是?(填写编号字母);从②的试管中分离出该晶体的方法是?(填写实验操作名称)。
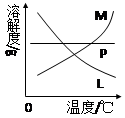
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性?。为什么??。
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-离子的物质的量??。
参考答案:(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O?(2)A、C? MnCl2+Cl2↑+2H2O?(2)A、C?
(3)①制取温度不同;? ②制取时碱的浓度也不同?(4)M?过滤
(5)不可,石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2?(6)0. 250mol
本题解析:(1)实验室制氯气的反应为MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O。 MnCl2+Cl2↑+2H2O。
(2)根据氧化性的强弱可知比MnO2氧化性强的NaBiO3和PbO2都可以制氯气。
(3)比较②③两个装置中所装药品可知,制取氯酸钾和次氯酸钠的差别是:制取温度不同,制取时碱的浓度也不同。
(4)溶解度随温度变化较大的物质冷却后有晶体析出,所以M符合。分离的方法是过滤。
(5)氯气褪色,是因为氯水中的HClO有强氧化性和漂白性,所以不能证明氯气有强氧化性。
(6)100mL 3.00mol/L的NaOH溶液恰好完全反应,根据原子守恒,说明溶液中n(Cl-)+n(ClO-)=0.3mol。又知溶液中n(ClO-)=0.05mol,所以n(Cl-)=0.25mol。
点评:本实验题难度较大,综合性较强,有利于对学生解题思维的锻炼。
本题难度:一般
5、选择题 将氯气制成漂白粉的主要目的是
[? ]
①使它转变成易溶于水的物质
②使它转变成稳定、便于储存的物质
③提高氯的质量分数
④提高漂白能力
A.①②
B.②③④
C.②③
D.②
参考答案:D
本题解析:
本题难度:简单
|