1、填空题 请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1 时,原子总数之比为 ,质量之比为 。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为 g。
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol—1,则:
①该气体的物质的量为 mol。
②该气体在标准状况下的体积为 L。
③该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度为 mol·L—1。
(4)将5 mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是 mol·L—1。
(5)用等体积的0.1 mol·L—1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42—完全沉淀,则三种硫酸盐的物质的量浓度之比为 。
参考答案:(12分)
(1)3∶4 4∶5 (2)8 (3)①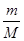 ②
②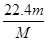 ③
③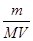 (4)10a/b mol/L (5)2∶6∶3
(4)10a/b mol/L (5)2∶6∶3
本题解析:(1)、设SO2和SO3中分子个数均为x个,则它们所含原子总数之比为(x+2x)∶(x+3x)=3∶4;由于n=N/NA,则它们的物质的量之比为1∶1 ,设均为ymol;由于m=n?M,则它们的质量之比为(64y)∶(80y)=4∶5;(2)、盐酸与氢氧化钠中和反应式为NaOH+HCl=NaCl+H2O,由于两反应物的化学计量数之比等于物质的量之比,则消耗NaOH的物质的量为0.2mol;由于m=n?M,则NaOH的质量为0.2mol×40g/mol=8g;(3)、①由于n=m/M,则该气体的物质的量为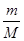 mol;②由于V=n×22.4L/mol,则该气体气体为
mol;②由于V=n×22.4L/mol,则该气体气体为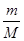 mol×22.4L/mol=
mol×22.4L/mol=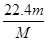 L;③由于c=n/V,则该气体溶解所得溶液中溶质的物质的量浓度为
L;③由于c=n/V,则该气体溶解所得溶液中溶质的物质的量浓度为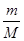 mol÷VL=
mol÷VL=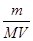 mol/L;(4)由稀释定律可知,稀释前后硝酸镁的物质的量相等,c1?V1=c2?V2,则稀释后硝酸镁的物质的量浓度为5a/bmol/L;硝酸镁的电离方程式为Mg(NO3)2=Mg2++2NO3—,生成物与反应物的化学计量数之比等于物质的量之比,则稀释后硝酸根离子浓度为10a/bmol/L;(5)、沉淀反应式均为Ba2++SO42—=BaSO4↓,两反应物的化学计量数之比等于物质的量之比,由于三反应消耗的氯化钡相同,设Ba2+和SO42—均为xmol;三种可溶性硫酸盐的电离方程式为:Fe2(SO4)3=2Fe3++3SO42—、Na2SO4=2Na++SO42—、KAl(SO4)2=K++Al3++2SO42—,其中反应物和硫酸根离子的化学计量数之比等于物质的量之比,则消耗的Fe2(SO4)3、Na2SO4、KAl(SO4)2分别为x/3mol、xmol、x/2mol;由于三种硫酸盐溶液体积相同,c=n/V,则Fe2(SO4)3、Na2SO4、KAl(SO4)2的物质的量浓度之比为x/3∶x∶x/2=2∶6∶3。
mol/L;(4)由稀释定律可知,稀释前后硝酸镁的物质的量相等,c1?V1=c2?V2,则稀释后硝酸镁的物质的量浓度为5a/bmol/L;硝酸镁的电离方程式为Mg(NO3)2=Mg2++2NO3—,生成物与反应物的化学计量数之比等于物质的量之比,则稀释后硝酸根离子浓度为10a/bmol/L;(5)、沉淀反应式均为Ba2++SO42—=BaSO4↓,两反应物的化学计量数之比等于物质的量之比,由于三反应消耗的氯化钡相同,设Ba2+和SO42—均为xmol;三种可溶性硫酸盐的电离方程式为:Fe2(SO4)3=2Fe3++3SO42—、Na2SO4=2Na++SO42—、KAl(SO4)2=K++Al3++2SO42—,其中反应物和硫酸根离子的化学计量数之比等于物质的量之比,则消耗的Fe2(SO4)3、Na2SO4、KAl(SO4)2分别为x/3mol、xmol、x/2mol;由于三种硫酸盐溶液体积相同,c=n/V,则Fe2(SO4)3、Na2SO4、KAl(SO4)2的物质的量浓度之比为x/3∶x∶x/2=2∶6∶3。
考点:考查物质的量、微粒数、摩尔质量、质量、气体的体积、气体摩尔体积、物质的量浓度、稀释定律、物质的量在化学方程式、电离方程式计算中的应用等相关知识。
本题难度:一般
2、计算题 (8分)往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示。试解答下列问题:
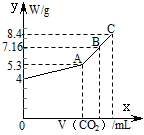
(1)A点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL(标准状况下,下同)。
(2)C点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL。
(3)B点时M的组成成分为________(用化学式表示),通入的CO2的体积为________ mL。
(4)该NaOH溶液的物质的量浓度为________。
参考答案:(1)Na2CO3 1120 (2)NaHCO3 2240 (3)Na2CO3和NaHCO3 1792 (4)1.0 mol·L-1
本题解析:从W的质量可以看出A点的质量为5.3g,所以A点M的化学式为Na2CO3,物质的量为0.05mol,所以通入CO2的体积为1120 mL。C点的质量为8.4g,所以C点M的化学式为NaHCO3,物质的量为0.1mol,通入CO2的体积为2240 mL。B点的组成则为Na2CO3和NaHCO3,根据混合物的总质量为7.16g,原NaOH的质量为4g,可以求出通入CO2的体积为1792 mL。一点CO2都不通,固体A的质量为4g,说明100mLNaOH溶液中有4gNaOH,则c(NaOH)=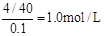 。2与NaOH的反应
。2与NaOH的反应
点评:本题比较基础简单,只要根据图像计算就可以。
本题难度:一般
3、计算题 小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打每片含0.50gNaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是?mol。
(2)胃舒平每片含0.245gAl(OH)3,中和胃酸时,6片小苏打相当于胃舒平?片。
(3)达喜的化学成分是铝和镁的碱式盐:取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时正好完全反应,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比?。
参考答案:(1)0.012(2分) (2)3.8(2分) (3)16:1(2分)
本题解析:(1)2片小苏打所含NaHCO3的质量为0.50g×2=1.0g,其物质的量为1.0g÷84g/mol=0.012mol,
由HCO3-+H+=CO2↑+H2O,可知被中和的H+是n(H+)=0.012mol。
(2)6片小苏打的物质的量为0.012mol×3=0.036mol,即中和的H+为0.036mol,而每片的Al(OH)3的物质的量为0.245g÷78g/mol=0.0031mol,由Al(OH)3+3H+=Al3++3H2O可知,Al(OH)3的片数为:0.036mol÷0.0031mol÷3=3.8片。
(3)碱式盐中加入HCl,首先是碱式盐中的OH-和CO32-与H+(42.5mL)反应生成H2O和HCO3—,然后HCO3—继续与盐酸反应,消耗45.0mL时正好反应完全。所以n(HCO3-)=2.0mol?L-1×(0.045L—0.0425L)=0.005mol,即n(CO32-)=0.005mol,H+与CO32-、OH-反应的H+的总物质的量为:2.0mol?L-1×0.0425L=0.085mol,所以n(OH-)=0.08mol,该碱式盐样品中氢氧根与碳酸根的物质的量之比为16∶1。
本题难度:一般
4、选择题 下列说法不正确的是(设NA表示阿伏加德罗常数的值)
A.可用盐析法分离NaCl溶液和淀粉胶体
B.天然油脂的分子中含有酯基,属于酯类
C.T℃时,1 L pH=6的纯水中,含有的OH-数目为l×10-6NA
D.12.0 gNaHSO4固体中含有的阳离子数目为0.1 NA
参考答案:A
本题解析:A、溶液可以透过半透膜,而胶体不能透过半透膜,所以可用渗析法分离NaCl溶液和淀粉胶体,但不能用盐析法分离,蛋白质可以利用盐析法进行分离和提纯,A不正确;B、油脂是高级脂肪酸和甘油形成的酯类,因此天然油脂的分子中含有酯基,属于酯类,B正确;C、T℃时,1 L pH=6的纯水中,氢离子的浓度是1×10―6mol/L。由于纯水显中性,所以OH-的浓度也是1×10―6mol/L,则1L纯水中含有的OH-数目为l×10-6NA,C正确;D、12.0gNaHSO4的物质的量是12.0g÷120g/mol=0.10mol。由于硫酸氢钠是Na+和HSO4-构成的离子化合物,所以固体中含有的阳离子数目为0.1NA,D正确,答案选A。
本题难度:简单
5、选择题 NA表示阿伏加德罗常数,下列说法不正确的是(?)
A.H2SO4的摩尔质量与NA个硫酸分子的质量在数值上相等
B.NA个氧气分子和NA个氮气分子的质量比为8∶7
C.28 g氮气所含原子数目为NA
D.在标准状况下,0.5 NA个氯气分子所占的体积为11.2 L
参考答案:C
本题解析:氮气是2个氮原子构成的,28g氮气是1mol,含有2NA个氮原子,选项C不正确,其余都是正确的,答案选C。
本题难度:一般