1、选择题 下列叙述错误的是
A.烧碱和消石灰都是碱
B.金属与盐溶液的反应都是置换反应
C.钢是用量最大、用途最广的合金
D.金属钾、钠、及钾钠合金的熔点关系:钠>钾>钾钠合金
参考答案:B
本题解析:略
本题难度:一般
2、选择题 将Na2O2投入FeCl2溶液中,可观察到的现象是(? )
A.生成白色沉淀
B.生成红褐色沉淀
C.有气泡产生
D.无变化
参考答案:BC
本题解析:本题主要考查Na2O2的性质及用途。Na2O2化学性质活泼,与水或CO2等发生反应生成O2。
2Na2O+2H2O2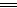 4NaOH+O2↑
4NaOH+O2↑
2Na2O2+2CO2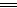 2Na2CO3+O2↑
2Na2CO3+O2↑
此外Na2O2还具有较强的氧化性,能将Fe2+氧化为Fe3+,分析本题中涉及的化学反应有:
2Na2O2+2H2O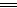 4NaOH+O2↑
4NaOH+O2↑
FeCl2+2NaOH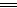 Fe(OH)2+2NaCl
Fe(OH)2+2NaCl
4Fe(OH)2+O2+2H2O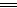 4Fe(OH)3(红褐色)↓
4Fe(OH)3(红褐色)↓
从以上反应知AD不正确,BC正确。
本题难度:一般
3、计算题 Na2CO3和NaHCO3的混合粉末共14.8g,加水制成溶液,然后向该溶液中加入碱石灰12.4g,待完全反应后(指CO32-,HCO3-,Ca2+已完全转化为CaCO3),加热除去水分,最后得固体29g。求Na2CO3,NaHCO3,CaO,NaOH各为多少克?
参考答案:10.6g? 4.2g? 8.4g? 4g
本题解析:混合体系增重是水参加反应的结果,且nH2O=nNa2CO3,故从水的质量的差入手求解。设混合物中Na2CO3为xmol,x=[29-(14.8+12.4)]/18,解得x=0.1mol。故Na2CO3的质量为:106×0.1=10.6g,NaHCO3的质量为:14.8-10.6=4.2g;CaO的质量为:56×(0.1+4.2/84)=8.4g(由反应方程式可知nCaO=nNa2CO3+nNaHCO3),NaOH的质量为:12.4-8.4=4g。
本题难度:一般
4、选择题 下列有关钠及其化合物的性质描述不正确的是
A.钠与水反应产生氢氧化钠和氢气
B.钠在空气中燃烧的产物为氧化钠
C.碳酸钠比碳酸氢钠更稳定
D.过氧化钠与二氧化碳反应生成碳酸钠和氧气
参考答案:B
本题解析:略
本题难度:简单
5、选择题 在不同反应中既能吸收CO2,又能参加反应放出CO2的是
A.Na OH
B.Na 2CO3
C.NaHCO3
D.Ca(OH)2
参考答案:B
本题解析:B选项中Na2CO3+HCl=CO2+NaCl;Na2CO3+CO2+H2O=2NaHCO3。
点评:本题需熟练掌握钠的化合物性质及方程式。
本题难度:一般