1、选择题 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH+3O2+4OH-  ?2CO32-+6H2O,则下列说法正确的是?
?2CO32-+6H2O,则下列说法正确的是?
[? ]
A.构成该电池的正极和负极必须是两种活性不同的金属
B.充电时有CH3OH生成的电极为阳极
C.放电时电解质溶液的pH逐渐增大
D.放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O
E.充电时每生成1 mol CH3OH转移12mol电子
参考答案:D
本题解析:
本题难度:一般
2、选择题 如图中三个电解装置中都盛有相同体积、相同物质的量浓度的CuSO4溶液,通电一段时间并且通过的电量相同时,CuSO4溶液物质的量浓度大小关系正确的是( )

A.②>③>①
B.①>②>③
C.②=③>①
D.①=②=③
参考答案:①是电解装置,电解硫酸铜的阴极发生反应:Cu2++2e-=Cu;
②属于在金属铁上镀铜的原理,前后过程中溶液中的铜离子浓度不变;
③属于电解精炼铜的原理,阴极上先发生反应Cu2++2e-=Cu,但是阳极上活泼金属Zn失电子完毕后,是金属铜失电子形成铜离子进入电解质的过程.
综上可知,通电一段时间并且通过的电量相同时,CuSO4溶液物质的量浓度大小关系是②>③>①.
故选A.
本题解析:
本题难度:一般
3、填空题 某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。
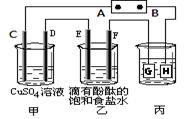
(1)A为电源的?极;
(2)E的电极反应式为:?;
(3)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为?;
(4)在常温下,现用丙装置给铁镀铜,则H电极材料应该是?,
当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为?(假设溶液体积为1L);
(5)在电解一段时间后在甲中加入适量?可以使溶液恢复到原来的浓度。
参考答案:(1)负极?(2)? 2H+2e-=H2↑?(3)? 2:1:2:2?(4)?铜? 13?
(5)CuO(若考虑到水开始电解Cu(OH)2也可以)
本题解析:考查电化学的应用。
(1)C电极表面有铜析出,说明C是阴极,所以A是电源的负极,B是正极H、F、D都是阳极,G和E是阴极。
(2)E是阴极,根据离子的放电顺序可知,溶液中的氢离子放电,反应式为2H+2e-=H2↑。
(3)根据离子的放电能量可判断,C、D、E、F电极产生的单质铜、氧气、氢气和氯气。根据电子的得失守恒可知,四种单质的物质的量之比是2:1:2:2。
(4)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,H是阳极,所以电极材料是铜。3.2g铜转移电子是 ,所以乙中生成的氢氧化钠是0.1mol,浓度是0.1mol/L,则pH=13。
,所以乙中生成的氢氧化钠是0.1mol,浓度是0.1mol/L,则pH=13。
(5)甲中的电解产物是铜、氧气和硫酸,所以要使溶液恢复到原来的浓度,应该加入氧化铜。
本题难度:一般
4、填空题 (共6分,每空2分).从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________________________;
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是________________________________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_________________________________。
参考答案:(1)HCl,CuCl2(2)Na2SO4,H2SO4(3)NaCl,CuSO4
本题解析:略
本题难度:简单
5、简答题 有一硝酸盐晶体,其化学式为M(NO3)x?yH2O,相对分子质量为242.取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属全部析出.经称量阴极增重0.32g.求:
(1)金属M的相对原子质量及x、y值.
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)
参考答案:(1)n(M)=n[M(NO3)x?yH2O]=1.21g242g/mol=0.005mol;
当有0.01mol电子发生转移时,溶液中金属全部析出.经称量阴极增重0.32g;
Ar(M)=0.320.005=64;
M的化合价=0.01mol0.005mol=2;
所以x=2
根据64+2(14+48)+18y=242
得y=3
答:金属M的相对原子质量为64,x为+2、y为3;
(2)电解总反应为2M(NO3)2+2H2O通电.2M+4HNO3+O2↑,0.01mol电子转移,溶液中氢离子增加和氢氧根离子减小相同,依据电极反应计算得到,4OH--4e-=2H2O+O2↑,反应过程中氢氧根离子减小0.01mol目前溶液中增加氢离子物质的量为0.01mol,氢离子浓度=0.01mol0.1L=0.1mol/L,溶液pH=1,
答:电解后溶液的pH为1.
本题解析:
本题难度:一般