1、实验题 (15分)Fe2O3俗称氧化铁红,常用作油漆着色剂。工业以煤矸石(主要成分:SiO2 49.5%;Fe2O3 20.6%;Al2O318.9%,以及MgO、FeO等其他杂质)制备并研究氧化铁红的应用。
(一)制备氧化铁红
1.预处理:将煤矸石粉碎,在350℃下焙烧2小时。
2.加酸溶解:将预处理后的煤矸石溶于质量分数为15%过量的硫酸溶液中,过滤。在滤液中加入的H2O2。
3.调节pH:在上述滤液中加1mol/LNaOH溶液调节溶液的pH,再过滤,得到滤渣。
4.产品处理:将滤渣进行水洗、烘干、煅烧、研磨、过筛得产品。
已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
|
开始沉淀
| 1.3
| 3.3
| 7.5
| 10.3
|
完全沉淀
| 2.8
| 5.2
| 9.7
| 12.2
|
请回答下列问题:
(1)预处理时,将煤矸石焙烧2小时的目的是?。
(2)酸浸操作中,过量H2SO4的作用是?。
在实验室中进行该操作时,用到玻璃仪器有?、?。
(3)用NaOH溶液调节pH的最佳范围是?。若从第二次过滤的滤液中获取较纯净的硫酸镁晶体,应补充的操作是?、洗涤后,干燥即得。
(4)产品处理时,对滤渣水洗的操作是 ?。
(二)分析与讨论:
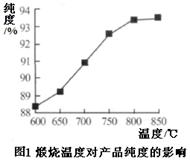
(5)产品处理时,煅烧温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图1所示,则煅烧时温度最好控制在?℃。
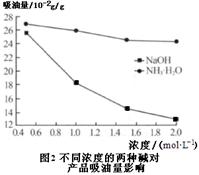
(6)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图2所示,则上述生产中在调节溶液pH时,选用NaOH溶液而不选用氨水的原因是?。
参考答案:(1)将煤矸石中的矿物转化为氧化物,便于酸浸?(2分)
(2)提高浸取率,抑制Fe3+等水解?(2分)
烧杯、玻璃棒?(各1分)
(3)2.8≤pH<3.3;(2分)?继续加碱调pH至12.2,将沉淀分离并洗净后,溶于足量稀硫酸,再蒸发(浓缩)、冷却(结晶)、过滤?(2分)
(4)加水恰好浸没滤渣,待滤尽后重复2~3次?(2分)
(5)800?(1分)
(6)用NaOH溶液,获得的氧化铁表面积小,吸油量低(2分)
本题解析:(1)将煤矸石焙烧2小时,反应充分,可将煤矸石中的矿物转化为氧化物,便于酸浸。
(2)酸浸后生成Fe2(SO4)3,所以过量H2SO4可以提高浸取率,抑制Fe3+等水解。
(3)根据表中数据,Fe3+完全沉淀时的pH为2.8,而Al3+开始沉淀时的pH为3.3,要使Fe3+完全转化为沉淀而不含杂质,调节pH的最佳范围是2.8≤pH<3.3;继续加碱调pH至12.2,Mg2+完全转化为Mg(OH)2沉淀,将沉淀分离并洗净后,溶于足量稀硫酸,再蒸发(浓缩)、冷却(结晶)、过滤,可获取较纯净的硫酸镁晶体。
(4)滤渣水洗的操作是:加水恰好浸没滤渣,待滤尽后重复2~3次。
(5)根据图1曲线,800℃时产品的纯度达到较大值,再升温,纯度升高不大,所以煅烧时温度最好控制在800℃
(6)根据图2两条曲线可知:用NaOH溶液,获得的氧化铁表面积小,吸油量低。
本题难度:一般
2、选择题 下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是(?)
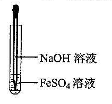
A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色絮状沉淀
C.可利用右图所示装置,制备氢氧化亚铁
D.实验中所用氢氧化钠溶液应预先煮沸
参考答案:B
本题解析:氢氧化亚铁极易被空气氧化生成氢氧化铁,A正确;氢氧化亚铁是一种白色沉淀,B不正确;由于氢氧化亚铁极易被氧化,所以滴管应该插在溶液下面,C正确;D正确,煮沸的目的是排出溶液中溶解的氧气,防止氧化氢氧化亚铁,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见考点。该题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力。
本题难度:简单
3、选择题 将Fe、Cu加入含Fe2+、Fe3+和Cu2+的溶液中充分反应,如Fe有剩余,则反应器中金属元素的存在形式只能是
A.Cu、Fe3+、Fe
B.Fe2+、Fe3+、Fe
C.Cu、Cu2+、Fe
D.Cu、Fe2+、Fe
参考答案:D
本题解析:铁是活泼的金属,所以如果铁剩余,则一定不可能存在铁离子和铜离子,所以答案选D。
本题难度:一般
4、填空题 聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
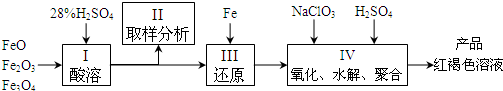
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______.
(a)玻璃棒 (b)烧杯? (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是______和确定氧化Fe2+所需NaClO3的量:
(a)?控制溶液中Fe2+与Fe3+含量比 (b)?确保铁的氧化物酸溶完全? (c)?确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
______?Fe2++______ClO3-+______H+=______Fe3++Cl-+______
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂______.
(a)?NaOH (b)?FeSO4 (c)?BaCl2 (d)?NaClO3
需要测定Fe2O3和______的质量(填写化合物的化学式).
参考答案:(1)配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,故选:ab;?
(2)因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需NaClO3的量,故选:C;?
(3)Fe2+由+2价升高到+3价,ClO3-中Cl的化合价从+5价降低到-1价,得6Fe2++ClO3-+H+--6Fe3++Cl-,由电荷守恒、质量守恒得:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,故答案为:6;1;6;3H2O;
(4)因SO42?与Fe3+都采用沉淀法加以测定,根据测定Fe2O3来测定Fe3+的物质的量,根据测定?BaSO4的质量来测定SO42?的物质的量;故答案为:ac;?BaSO4
本题解析:
本题难度:简单
5、实验题 试简述在FeCl3溶液中加入NaOH溶液时的反应现象,并写出有关反应的化学方程式。
现象:______________________________________________;
化学方程式:______________________。
参考答案:现象:生成红褐色沉淀
化学方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl
本题解析:Fe3+与OH-发生反应生成红褐色的沉淀。
点评:本题考查了Fe3+与碱溶液间的反应,完成此题,可以依据从教材中所学的知识来做答。
本题难度:简单