1、选择题 下列有关铁及其化合物的说法中不正确的是( )
A.分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3 ∶2 ∶3
B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C.工业上可用铁制容器储存、运输浓硝酸、浓硫酸
D.检验某物质是否含Fe2O3的操作步骤为:样品→粉碎→加热→溶解→过滤→向滤液中加KSCN溶液
参考答案:D
本题解析:样品在粉碎、加热、溶解、过滤的过程中其中可能含有的Fe2+已被氧化,故D不正确。
本题难度:一般
2、选择题 铁片放入下列溶液中,反应时无气体放出,取出后铁片质量减轻,则该溶液是
A.稀硫酸
B.CuSO4
C.AgNO3
D.Fe2(SO4)3
参考答案:D
本题解析:铁和稀硫酸反应生成硫酸亚铁和氢气;和硫酸铜反应生成硫酸亚铁和铜,铁片的质量增加;铁和硝酸银溶液反应,生成硝酸亚铁和银,铁片的质量增加;铁和硫酸铁反应生成硫酸亚铁,铁片的质量减少,答案选D。
点评:该题是高考中的常见考点之一,主要是检验学生对铁单质化学性质的熟悉掌握程度,以及灵活运用知识的能力。
本题难度:一般
3、选择题 化学反应的发生不仅与物质的性质有关,还与反应物质的浓度、反应温度、相对量的多少等因素有关.下列各组的两物质中,不论在何种反应条件下,只要是能发生反应,就只能发生一个化学反应的是( )
A.Cu与HNO3溶液
B.CO2与NaOH溶液
C.Zn与H2SO4溶液
D.Fe2O3与HCl溶液
参考答案:D
本题解析:
本题难度:简单
4、实验题 孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实
验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:

(1)研磨孔雀石的目的是?。浸泡孔雀石的试剂A若选用过量的稀硫酸,则固体a是??(填化学式)。
(2)试剂B的目的是将溶液中的Fe2+转化为Fe3+,则试剂B宜选用??(填序号):
A.酸性KMnO4溶液? B.双氧水? C.浓硝酸? D.氯水
相应的离子方程式为:?。
(3)试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离。则试剂C宜选用?(填序号):
A.稀硫酸? B.NaOH溶液? C.氨水? D.CuO
固体C的化学式为?。
(4)1 mol氨气通过加热的Cu2(OH)2 CO3可以产生1.5 mol金属铜,则该反应的化学方程式为?。
(5)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3 mol/L,必需将溶液调节至pH=?。
参考答案:(1)(共4分)增大固体表面积(1分),以增大反应速率(1分)[类似意思均可]?
SiO2(2分)
(2)(共4分)B(2分)? 2Fe2++2H++H2O2=2Fe3++2H2O(2分)(未配平1分,写为化学方程式2FeSO4 + H2SO4 + H2O2 = Fe2(SO4)3 + 2H2O且正确1分)
(3)(共4分)D(2分)? Fe(OH)3(2分)
(4)(共3分)3Cu2(OH)2CO3 + 4NH3 6Cu + 3CO2 + 9H2O +2 N2(化学式1分、配平均1分,条件1分。)
6Cu + 3CO2 + 9H2O +2 N2(化学式1分、配平均1分,条件1分。)
(5)(共2分)2
本题解析:(1)研磨孔雀石的目的是为了酸溶速率更快,所以答案为“增大固体接触面积,加快反应速率”,酸溶过程中不溶的固体为杂质SiO2。
(2)把Fe2+转化为Fe3+ 应该加入氧化剂,且不能带入杂质离子,所以用双氧水,选B。相应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O。
(3)因为目标产品是CuSO4·5H2O晶体,所以调节pH值使铁离子沉淀应选用的试剂不能带入杂质离子,所以选用固体CuO,所以沉淀物c为Fe(OH)3 和过量的CuO。
(4)碱式碳酸铜中通入氨气后有铜单质生成,说明铜被还原,NH3做还原剂。因为1mol氨气还原得到1.5mol铜单质,根据铜+2→0价,可知转移电子3mol,得失电子守恒,所以NH3失去电子也为3mol,所以可推测得NH3被氧化为了N2,所以可以得知其他产物还有CO2、H2O。所以列出反应物NH3+ Cu2(OH)2 CO3→Cu+ N2+CO2+H2O,然后根据氧化还原反应方程式配平得:3Cu2(OH)2CO3 + 4NH3 6Cu + 3CO2 + 9H2O +2 N2 。
6Cu + 3CO2 + 9H2O +2 N2 。
(5)根据Fe(OH)3溶解平衡Fe(OH)3 (s)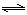 ?Fe3+ (aq)+3 OH- (aq)可得Ksp ="c(" Fe3+ ) ·c3(OH-?)= 1×10-39 ,所以把c(Fe3+)=1×10—3 mol/L带入公式中,计算得c(OH-?)= 1×10-12 ,所以c(H+?)="Kw/" c(OH-?)= 10-2 ,所以pH=2。
?Fe3+ (aq)+3 OH- (aq)可得Ksp ="c(" Fe3+ ) ·c3(OH-?)= 1×10-39 ,所以把c(Fe3+)=1×10—3 mol/L带入公式中,计算得c(OH-?)= 1×10-12 ,所以c(H+?)="Kw/" c(OH-?)= 10-2 ,所以pH=2。
本题难度:一般
5、选择题 常温下,将铁片放入下列溶液中,能观察到有大量气泡产生的是

A.浓硫酸
B.稀硫酸
C.氢氧化钠溶液
D.硫酸铜溶液
参考答案:B
本题解析:A错,常温下,铁与浓硫酸发生钝化阻止反应的进一步进行。
B可以,铁与稀硫酸反应放出氢气。
C错,铁与氢氧化钠不发生反应。
D错,铁与硫酸铜发生置换,生成铜,不放出气体。
本题难度:简单