1、判断题 固体发光材料是一种能将激发的能量转变为可见光的固体物质。在基质中掺入杂质,含量可达千分之几或百分之几,可调整发光效率、余辉及发光光谱。如在刚玉Al2O3基质中掺入0.05~1.0%的Cr3+及在Y2O3基质中掺入Eu3+等均可制成固体发光材料。
⑴推测Al2O3基质中掺入Cr3+的发光原理。
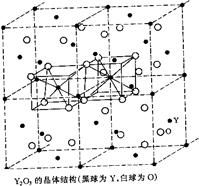
⑵Y2O3属立方晶系,将Y2O3的立方晶胞分为8个小立方体,Y在小立方体的面心和顶点,O位于小立方体内的四面体空隙,画出这样四个小立方体,指出Y和O的配位数。
参考答案:⑴Al3+和O2-是满壳层电子结构,能隙大,电子不易激发,故无色;(2分)
掺入的Cr3+是过渡金属,具有3d电子,在晶体中置换部分Al3+形成较低的激发态能级,两个强吸收带分别吸收黄绿色及蓝色的光,只有红光透过,因而掺Cr3+的刚玉呈绚丽的红色,称为红宝石。(3分)
⑵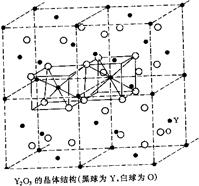 (4分)
(4分)
Y的O的配位数为6,O的Y配位数为4。(1分)
本题解析:⑴本题考察学生对主族元素、过渡金属离子构型的掌握情况。Al3+和O2-是是主族元素的阳离子和阴离子,都属于8电子结构,价电子不易被激发,因此为无色。当部分Cr3+置换出Al3+后,由于Cr3+为d3结构,电子易被激发,只能让红光通过(红宝石的颜色),因此能发红光。
⑵由于O位于小立方体的四面体空隙,即O的配位数为4,根据化学式可知,Y的配位数为6(配位数之比与原子数成反比)。根据题意,Y为面心立方最密堆积,因此Y原子与四面体空隙数的比例为1∶2,因此O原子在四面体空隙中的占有率为3/4,根据晶胞的对称性原理,可以把晶胞划分成八个小的立方体,其中共棱的立方体是相同的,共面的立方体不同:一种小立方体中Y位于顶点和面心,O位于六个四面体的空隙;另一个共面的立方体,O也位于六个四面体空隙中,但是未占四面体空隙呈对称关系。其中四个四面体的示意图如下所示:
本题难度:一般
2、填空题 (8分)晶体是质点(分子、离子、或原子)在空间有规则地排列的,具有整齐外形,以多面体出现的固体物质。在空间里无限地周期性的重复能成为晶体的具有代表性的最小单元,称为晶胞。一种Al-Fe合金的立体晶胞如图所示。
⑴确定该合金的化学式____________。
⑵若晶胞的边长为a nm,阿伏加德罗常数为NA,则此合金的密度为_____________g/cm3。(化为最简)
⑶取一定质量的该合金粉末溶于足量的稀NaOH溶液中,待反应完全停止后得到气体6.72 L。过滤,将残渣用蒸馏水洗净后,取其质量的十分之一,投入100mL一定浓度的稀硝酸中,恰好完全反应,共收集到气体0.672L。(气体体积均在标准状况下测定)
①计算硝酸的物质的量浓度。
②最终所得溶液中Fe3+的物质的量浓度(假设溶液体积仍为100mL)。
(1)确定该合金的化学式____________
(2)__________________g/cm3(化为最简)
(3)__________________________________________
①
____________________________
②
___________________________。
参考答案:⑴Fe2Al?⑵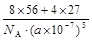 或
或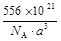
⑶①3Fe+8HNO3=3Fe(NO3)2+2NO+4H2O? Fe+4HNO3=Fe(NO3)3+NO+2H2O
根据铁和稀硝酸的反应,不管铁被氧化到什么价态,均有
n(HNO3)=4 n(NO)=4×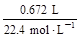 =0.12mol?c(HNO3)=
=0.12mol?c(HNO3)=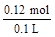 =1.2mol/L
=1.2mol/L
②2Al+2NaOH+H2O=2NaAlO2+3H2↑
开始所取合金中n(Al)=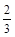 n(H2)=
n(H2)=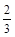 ×
×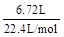 =0.2 mol
=0.2 mol
与硝酸反应的n(Fe)=0.2 mol×2×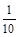 =0.04 mol?
=0.04 mol?
则最终所得溶液中?n(Fe2+)+n(Fe3+)=0.04 mol
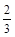 n(Fe2+)+n(Fe3+)=
n(Fe2+)+n(Fe3+)=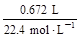 =0.03 mol(或电子守恒:2n(Fe2+)+3n(Fe3+)=3×0.03 mol)
=0.03 mol(或电子守恒:2n(Fe2+)+3n(Fe3+)=3×0.03 mol)
解得n(Fe3+)=0.01 mol?c(Fe3+)=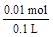 =0.1mol/L
=0.1mol/L
本题解析:略
本题难度:简单
3、选择题 关于SiO2晶体的叙述中,正确的是 ( )。
A.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
B.60 g SiO2晶体中,含有2NA个Si—O键
C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D.SiO2晶体中含有1个硅原子,2个氧原子
参考答案:C
本题解析:SiO2为原子晶体,晶体中不存在分子,SiO2晶体中一个Si原子与周围4个O原子形成4个Si—O键,一个O原子和两个Si原子形成2个Si—O键所以SiO2晶体中Si、O原子个数比为2:1。在SiO2晶体中一个Si原子和4个O原子构成正四面体构型。所以正确的选项是C。2晶体构型
点评:原子晶体是一个三维的共价键网状结构,不存在单个小分子,是一个“巨分子”。所以其化学式表示原子的个数比,而不是分子式。
本题难度:一般
4、填空题 (10分)如右图所示,晶体硼的基本结构单元都是由硼原子组成的正二十面体,这个多面体中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。


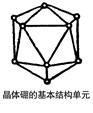

 (1)这个基本结构单元由?个硼原子组成,
(1)这个基本结构单元由?个硼原子组成,
 共含有?个B—B键。
共含有?个B—B键。



 (2)假设将此基本结构单元的每个顶角按一定比例且同等
(2)假设将此基本结构单元的每个顶角按一定比例且同等
 程度地削去(切点不重合),可得到另一个多面体,则此多面体含?
程度地削去(切点不重合),可得到另一个多面体,则此多面体含?
 个五边形,?个六边形。若再设此多面体的每个交点处有一个碳
个五边形,?个六边形。若再设此多面体的每个交点处有一个碳
 原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为?。
原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为?。
参考答案:(1)12、30?(每空2分)
(2)12、20? C60?(每空2分)
本题解析:略
本题难度:简单
5、选择题 有一种蓝色晶体[可表示为:MxFey(CN)6],经X-射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示。下列说法正确的是
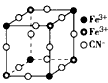
[? ]
A.该晶体的化学式为MFe2(CN)6
B.该晶体属于离子晶体,M呈+1价
C.该晶体属于离子晶体,M呈+2价
D.晶体中与每个Fe3+距离最近且等距离的CN-为3个
参考答案:AB
本题解析:
本题难度:简单