|
高中化学知识点大全《认识晶体》考点预测(2019年强化版)(六)
2020-07-08 00:06:08
【 大 中 小】
|
1、填空题 现有甲、乙、丙(如下图》三种晶体的晶胞:(甲中x处于晶胞的中心,乙中a处于
晶胞的中心),可推知:甲晶体中x与y的个数比是__________,乙中a与b的个数比是__________,丙晶胞中有_______个c离子,有____________个d离子。
参考答案:4:3? 1:1? 4? 4
本题解析:根据均摊法可知,甲中的晶胞中含有1个原子,而y原子的个数是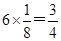 个,则甲晶体中x与y的个数比是4:3;乙晶胞中a原子的个数是1个,b原子的个数是 个,则甲晶体中x与y的个数比是4:3;乙晶胞中a原子的个数是1个,b原子的个数是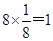 个,则乙晶胞中a与b的个数比是1:1;丙晶胞中c离子的个数是 个,则乙晶胞中a与b的个数比是1:1;丙晶胞中c离子的个数是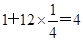 个,d离子的个数是 个,d离子的个数是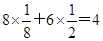 个。 个。
点评:该题是高考中的常见题型和重要的考点,侧重对学生能力的培养。该题的关键是明确均摊法的原理,然后结合题意和晶胞结构直接列式计算即可,有利于培养学生的逻辑思维能力和规范答题能力。
本题难度:一般
2、填空题 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有?(填序号)
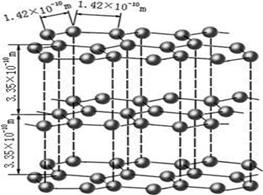
Aσ键;Bπ键;C氢键;D配位键;E分子间作用力;F金属键;G离子键
(2)下面关于晶体的说法不正确的是___________
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
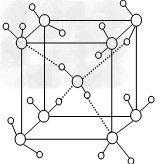
| (3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)  ? ?
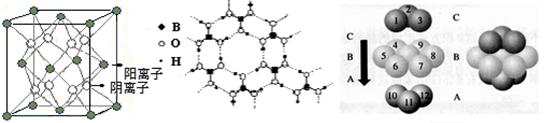
图Ⅰ?图Ⅱ?图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为?,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为?;
②H3BO3晶体中B原子杂化方式______ ;
③三种晶体中熔点高低的顺序为?(填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为?
(4) 碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_?____cm(用代数式表示)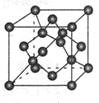
参考答案:(1)A B E(2分)
(2)C (1分)
(3)①12 (2分) 12 (2分)?
②sp2(1分)
③CaF2 > Cu >H3BO3(2分)?
分子间作用力(1分)
(4)8个 (2分)?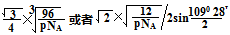 (2分) (2分)
本题解析:(1)石墨属于混合晶体,是层状结构,每一层里是碳原子之间形成的共价键;在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键。层与层之间是依靠分子间作用力(即范德华力)相连接的。
(2)同周期金属元素的熔点随原子序数增加,熔点由高到低的顺序是Al>Na>Mg,所以C错。
(3)①由图I可以看出晶体中与F离子最近且等距离的F离子数为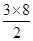 =12,由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为3+6+3=12,故答案为:12;12; =12,由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为3+6+3=12,故答案为:12;12;
②B原子都含有3个共价单键,所以采用sp2杂化;
③CaF2属于离子晶体,Cu 属于金属晶体,H3BO3属于分子晶体,不同类型晶体熔沸点判断一般来说按照原子晶体>离子晶体>分子晶体;金属晶体(除少数外)>分子晶体,H3BO3属于分子晶体,晶体受热熔化时,克服的微粒之间的相互作用为分子间作用力。
(4)晶胞中碳原子个数按照顶点8个×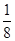 +面心6个× +面心6个×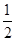 +体心3个×1=8个 +体心3个×1=8个
假设晶胞的边长为acm 晶胞的体积为a3 cm3, 晶体中最近的两个碳原子之间的距离为a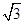 /4. /4.
ρ·a3/8=12/NA.a3=(8×1/2)/ρ·NA.所以a= 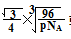
本题难度:一般
3、填空题 【三选一—物质结构与性质】
水是我们非常熟悉的物质,自然界的一切生命活动都离不开水。
(1)水分子中氧原子的杂化轨道类型为___________。H2O与H+以配位键结合成H3O+的立体结构为_____________。
(2)下列元素的电负性数据:H:2.1,O:3.5,F:4.0。 OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有: ①OF2中氧原子上有两对弧对电子,抵消了F-O键中共用电子对偏向F而产生的极性; ②从电负性上看,原因是_______________。
(3)污水中常含有Cr3+、Ag+、Hg2+等,需要加以处理。写出Cr3+的电子排布式:_____________。
(4)水在不同的温度和压力条件下可以形成11种不同结构的晶体,冰是人们迄今已知的由一种简单分子堆积出结构花样较多的化合物。其中冰一VII的晶体结构为一个如图所示的立方晶胞,每个水分子可与周围________个水分子以氢键结合,晶体中,1mol水可形成_____________mol氢键。
参考答案:(1)SP3;?三角锥形
(2)②氧与氢的电负性差大于氧与氟的电负性差。
(3)1s22s22p63s23p63d3
(4)4 ;?2
本题解析:
本题难度:一般
4、填空题 (15分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)单质铁属于______晶体,将FeCl3溶液加热蒸干,灼烧所得的物质是______ (填化学式):
(2)请写出铝与氢氧化钠溶液反应的化学方程式______________________________
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,在该深蓝色的浓溶液中加入乙醇所产生的现象是______,画出呈深蓝色的离子的结构式______.
写出Cu与氨水、双氧水反应的离子方程式:____________________________________.
(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,写出其化学方程式____________.
参考答案:(1)金属晶体(1分),Fe2O3(2分)
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(3分)
(3)析出深蓝色晶体(1分)?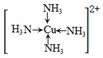 (2分) (2分)
Cu+4NH3·H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-(3分)
(4)FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O(3分)
本题解析:(1)单质铁属于金属晶体,FeCl3溶液存在Fe3+ + 3H2O  Fe(OH)3 + 3H+,加热蒸干促进水解生成氢氧化铁沉淀、灼烧氢氧化铁分解得Fe2O3;(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(3)金属Cu与双氧水发生氧化还原反应,生成的铜离子随即与一水合氨中的氮形成配位键,这种离子化合在乙醇中溶解度小而析出深蓝色晶体,其结构为 Fe(OH)3 + 3H+,加热蒸干促进水解生成氢氧化铁沉淀、灼烧氢氧化铁分解得Fe2O3;(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(3)金属Cu与双氧水发生氧化还原反应,生成的铜离子随即与一水合氨中的氮形成配位键,这种离子化合在乙醇中溶解度小而析出深蓝色晶体,其结构为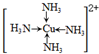 ,离子方程式是Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,同时碳酸氢根离子电离出的氢离子与碳酸氢根离子结合成二氧化碳和水,化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O。 ,离子方程式是Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,同时碳酸氢根离子电离出的氢离子与碳酸氢根离子结合成二氧化碳和水,化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O。
本题难度:一般
5、选择题 据报道,国外科学家用激光将置于铁室中石墨靶上的碳原子炸松,再用射频电火花喷射
氮气,此时碳氮原子结合成碳氮化合物的薄膜,此化合物熔点比金刚石更高,其原因是(?)
A.碳氮化合物的分子间作用力大于金刚石
B.氮原子最外层电子数比碳原子最外层电子数多
C.碳、氮原子构成网状结构的晶体,碳氮键比金刚石中碳碳键更短
D.碳、氮单质的化学性质均不活泼
参考答案:C
本题解析:A、碳氮化合物的熔点比金刚石更高,说明该化合物中的共价键的强度大于金刚石,错误;B、氮原子最外层电子数比碳原子最外层电子数多,不是熔点高的原因,错误;C、碳、氮原子构成网状结构的晶体,碳氮键比金刚石中碳碳键更短,共价键强度更强,所以熔点比金刚石更高,正确;D、碳、氮单质的化学性质均不活泼,与最外层电子数有关,不是熔点高的原因,错误,答案选C。
本题难度:一般
|  ?
?
