|
|
|
高中化学必备知识点《盐类水解的原理》高频试题预测(2019年最新版)(三)
2020-07-08 00:10:59
【 大 中 小】
|
1、选择题 下列有关说法正确的是( )
A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S)
B.常温下,0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+)
C.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,
溶液中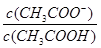 的值增大到原来的10倍 的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中:
| c(Na+)=c(CH3COOH)>c(CH3COO—)>c(H+)=c(OH—)
2、选择题 0.1 mol / L Na2CO3和0.1 mol / L NaHCO3溶液的pH值比较( )
A.大于
B.等于
C.小于
D.不能肯定
|
3、填空题 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g)+7O2(g) =6CO(g)+8H2O(g) △H =-2389.8 kJ/mol
②2CO(g) + O2(g) =2CO2(g) △H =-566 kJ/mol
③H2O(l) = H2O(g) △H ="+" 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g) +H2O(g)  CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| H2O
| CO
| CO2
| H2
|
甲 (质量/g)
| 1.8
| 8.4
| a
| 1
|
乙 (质量/g)
| 1.8
| 2.8
| 0
| 0
|
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是
;达到平衡时,乙容器中CO的转化率为
。
②下图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是
、
(答两个要点即可)。

(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为
;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时,溶液中c(HCO3-)∶c(CO32-) =
。
③ 0.1 mol/L Na2CO3溶液中c(OH-) -c(H+) =
[用含c(HCO3-)、c(H2CO3)的符号表示]。
4、选择题 常见有机反应类型有:①取代反应? ②加成反应? ③消去反应? ④酯化反应? ⑤加聚反应? ⑥缩聚反应? ⑦氧化反应? ⑧还原反应,其中可能在有机分子中新产生羟基的反应类型是( )
A.①②③④
B.⑤⑥⑦⑧
C.①②⑦⑧
D.③④⑤⑥
5、选择题 下列电离或水解方程式正确的是
A.Na2SO3的水解:SO32-+ 2H2O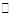 H2SO3 + 2OH-
H2SO3 + 2OH-
B.NaHCO3的电离:NaHCO3  Na + + H+ + CO32-
Na + + H+ + CO32-
C.KHS溶液中HS-的电离:HS-+ H2O  H3O+ + S2-
H3O+ + S2-
D.NaClO溶液与FeCl2溶液混合:2ClO- + Fe2+ + 2H2O =" 2HClO" + Fe(OH)2↓
 CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
CO2(g) +H2(g)该反应的平衡常数与温度的关系如下表:
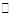 H2SO3 + 2OH-
H2SO3 + 2OH- Na + + H+ + CO32-
Na + + H+ + CO32- H3O+ + S2-
H3O+ + S2-