1、选择题 对于反应:CaCO3+2HCl=CaCl2+ H2O+CO2↑,下列说法正确的是?
?[? ]
A.用HCl和CaCl2表示的反应速率数据不同,但所表示的意义相同
B.不能用CaCO3的浓度变化来表示反应速率,但可用水来表示
C.用H2O和CO2表示的化学反应速率相同
D.用CaCl2浓度的减小表示其反应速率
参考答案:A
本题解析:
本题难度:简单
2、选择题 已知汽车尾气无害化处理反应为2NO(g)+2CO(g)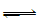 N2(g)+2CO2(g),下列说法中正确的是
N2(g)+2CO2(g),下列说法中正确的是
A.使用适当的催化剂不改变反应速率
B.降低压强能提高反应速率
C.升高温度能提高反应速率
D.改变压强对反应速率无影响
参考答案:C
本题解析:A、使用适当的催化剂可以加快反应速率,错误;B、降低压强,反应速率减慢,错误;C、温度升高,反应速率加快,正确;D、改变压强对反应速率有影响,错误,答案选C。
本题难度:一般
3、选择题 在一定条件下,N2和H2在密闭容器内反应合成NH3。下列说法不正确的是
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
参考答案:B
本题解析:A正确,反应开始时,反应物的浓度最高,生成物的浓度为0,所以有正反应速率最大,逆反应速率为零;B错,随着反应的进行,正反应速率逐渐减小,最后不为零,该反应为可逆反应,反应物不可能全部转化为生成物;C正确,随着反应的进行,生成物的浓度增大,逆反应速率逐渐增大,最后不变;D正确,随着反应的进行,反应物逐渐减小,浓度不断减小,正反应速率逐渐减小,最后不变;
本题难度:一般
4、填空题 (17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时,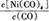 减小,则?H?0(填“>”或“<”)。
减小,则?H?0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。

若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数?(填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol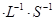 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: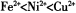 )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。
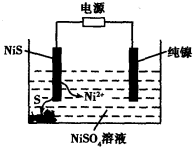
参考答案:(1)①<;②bd;不变;0.8mol﹒L—1﹒S—1。③增大CO的浓度或增大压强。(2)cd;
(3) 正极;NiS—2e- Ni2++S。
Ni2++S。
本题解析:(1)①对于反应:Ni(s)+4CO(g) Ni(CO)4(g),当温度升高时,
Ni(CO)4(g),当温度升高时,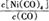 减小,说明平衡逆向移动,升高温度平衡向吸热反应方向移动,则该反应的逆向吸热,正向为放热反应,?H<0;②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,a.随着反应的进行,容器内气体的质量增大,物质的量减小,等压条件下容器体积减小,密度逐渐增大,达平衡时密度不变,与图像不符,错误;b.随着反应的减小,反应物的浓度逐渐减小,正反应速率逐渐减小,达平衡时正反应速率不变,与图像符合,正确;c.?H不随反应的进行而变化,不能作为平衡标志,错误;d.CO的转化率随反应的进行不断增大,达平衡时CO的转化率不变,与图像相符,正确,选bd;若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,影响平衡常数的外界因素为温度,温度不变,平衡常数不变;根据公式v=△n/V△t将题给数据代入计算得v(Ni(CO)4)=0.2mol﹒L—1﹒S—1,则0—3s内的平均反应速率v(CO)=0.8mol﹒L—1﹒S—1。③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为增大CO的浓度或增大压强。(2)迁移教材知识铜的电解精炼作答。以NiSO4溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼, a.电解过程中,电能转化为化学能,错误;b.粗镍作阳极,发生氧化反应,错误;c.精炼过程中比镍活泼的金属Fe、Zn以离子形式进入电解质溶液,活泼性比镍弱的金属Cu、Pt、Au进入阳极泥,正确;d.粗镍精炼时通过的电量与阴极析出镍的质量成正比,正确,选cd;(3) 根据题意知,电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,硫元素的化合价由—2价升高为0价,发生氧化反应,作电解池的阳极,与电源的正极相接。阳极的电极反应式为NiS—2e-
减小,说明平衡逆向移动,升高温度平衡向吸热反应方向移动,则该反应的逆向吸热,正向为放热反应,?H<0;②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,a.随着反应的进行,容器内气体的质量增大,物质的量减小,等压条件下容器体积减小,密度逐渐增大,达平衡时密度不变,与图像不符,错误;b.随着反应的减小,反应物的浓度逐渐减小,正反应速率逐渐减小,达平衡时正反应速率不变,与图像符合,正确;c.?H不随反应的进行而变化,不能作为平衡标志,错误;d.CO的转化率随反应的进行不断增大,达平衡时CO的转化率不变,与图像相符,正确,选bd;若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,影响平衡常数的外界因素为温度,温度不变,平衡常数不变;根据公式v=△n/V△t将题给数据代入计算得v(Ni(CO)4)=0.2mol﹒L—1﹒S—1,则0—3s内的平均反应速率v(CO)=0.8mol﹒L—1﹒S—1。③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为增大CO的浓度或增大压强。(2)迁移教材知识铜的电解精炼作答。以NiSO4溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼, a.电解过程中,电能转化为化学能,错误;b.粗镍作阳极,发生氧化反应,错误;c.精炼过程中比镍活泼的金属Fe、Zn以离子形式进入电解质溶液,活泼性比镍弱的金属Cu、Pt、Au进入阳极泥,正确;d.粗镍精炼时通过的电量与阴极析出镍的质量成正比,正确,选cd;(3) 根据题意知,电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,硫元素的化合价由—2价升高为0价,发生氧化反应,作电解池的阳极,与电源的正极相接。阳极的电极反应式为NiS—2e- Ni2++S。
Ni2++S。
本题难度:简单
5、选择题 下列四个数据都表示合成氨的反应速率,其中速率代表同一反应中的是( )
①V(N2)=0.6mol/(L?min)?②V(NH3)=1.8mol/(L?min)
③V(H2)=1.2mol/(L?min)?④V(H2)=0.045mol/(L?s)
A.①②
B.①③
C.③④
D.②④
参考答案:合成氨的反应为:3H2+N2

2NH3.
A、v(N2):v(NH3)=0.6mol/(L?min):V(NH3)=1.8mol/(L?min)=1:3,不等于化学计量数之比,不能表示相同条件下同一反应,故A错误;
B、V(N2):V(H2)=0.6mol/(L?min):1.2mol/(L?min)=1:2,不等于化学计量数之比,不能表示相同条件下同一反应,故B错误;
C、④V(H2)=0.045mol/(L?s)=2.7mol/(L?min),与③V(H2)=1.2mol/(L?min)不相等,不能表示相同条件下同一反应,故C错误;
D、④V(H2)=0.045mol/(L?s)=2.7mol/(L?min),V(NH3):V(H2)=1.8mol/(L?min):2.7mol/(L?min)=2:3,等于化学计量数,表示相同条件下同一反应,故D正确.
故选D.
本题解析:
本题难度:一般