1、选择题 对下列图象的描述正确的是( )
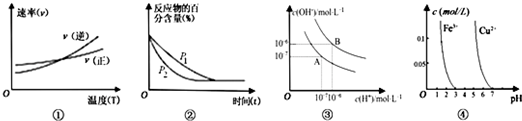
A.根据图①可推知反应A2(g)+3B2(g)?2AB3(g)的△H>0
B.图②可表示压强(P)对反应?2A(g)+2B(g)?3C(g)+D(s)的影响
C.图③中由A点到B点可采取的措施是向溶液中加入CH3COONa溶液
D.根据图④,除去CuSO4溶液中的Fe3+,可加入CuCO3调节pH至3~5
2、填空题 (17分)运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下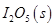 可用于检测CO,反应原理为:
可用于检测CO,反应原理为: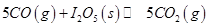
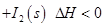 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量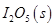 ,并通人1molCO,CO2的体积分数
,并通人1molCO,CO2的体积分数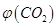 随时间的变化如下图所示。
随时间的变化如下图所示。
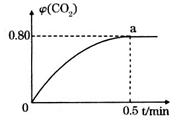
①0~0.5min内的平均反应速率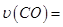 _____________。
_____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是____________(填代号)。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中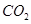 的体积分数
的体积分数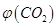 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以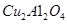 为催化剂,可以将
为催化剂,可以将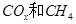 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则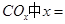 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则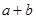 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应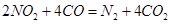 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
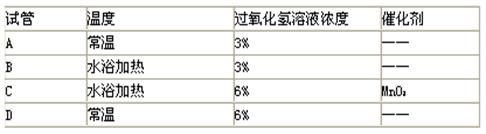
3、选择题 下列四个试管中,过氧化氢分解产生氧气的反应速率最慢的是
4、实验题 下表是稀硫酸与某金属反应的实验数据:
实验序号
| 金属质量/g
| 金属状态
| c(H2SO4)
/mol·L-1
| V(H2SO4)
/mL
| 溶液温度/℃
| 金属消失的时间/s
|
反应前
| 反应后
|
1
| 0.10
| 粉末
| 0.5
| 50
| 20
| 35
| 50
|
2
| 0.10
| 块状
| 0.8
| 50
| 20
| 35
| 200
|
3
| 0.10
| 粉末
| 0.8
| 50
| 20
| 36
| 25
|
4
| 0.10
| 块状
| 1.0
| 50
| 20
| 35
| 125
|
分析上述数据,请回答下列问题。
(1)实验1和3表明,?对反应速率有影响,能表明这种影响因素的实验还有?(填实验序号)。
(2)本实验中影响反应速率的其他因素还有?,其实验序号是?。该实验说明?,则反应速率越快;
(3)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
?。
5、填空题 T1℃时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间 | H2O | CO
0
1.00
1.50
t1
0.40
t2
0.90
|
(1)用H2表示反应在t1min内的平均速率为v(H2)=______.
(2)保持其他条件不变,若起始时向容器中充入1.50molCO和1.00molH2O(g),达到平衡时,n(CO2)=______.
(3)保持其他条件不变,在t2时向容器中再通入0.50molCO,与原平衡相比,达到新平衡时CO转化率将______(填增大或减小,下同),H2O的体积分数将______.
(4)保持其他条件不变,若起始时向容器中充入amolCO和bmolH2O(g),达到平衡时,CO2的体积分数为24%,a、b的值须满足的条件是______.
(5)温度升至T2℃,上述反应的平衡常数为0.64,则正反应的△H______0(填>或<).