1、选择题 对于3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为(? )
Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为(? )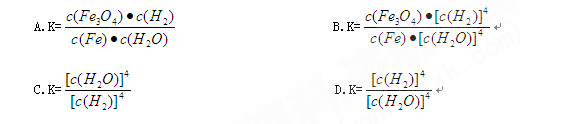
参考答案:D
本题解析:化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。根据方程式可知,铁和四氧化三铁都是固体,因此该反应的平衡常数表达式是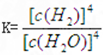 ,答案选D。
,答案选D。
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和检验。该题的关键是明确化学平衡常数的含义,然后结合具体的化学方程式灵活运用即可。需要特别注意的是固体或纯液体是没有浓度的,不应该出现在平衡常数表达式中。
本题难度:简单
2、选择题 在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是?
2Z(g),此反应达到平衡的标志是?
A.容器内压强不随时间变化
B.容器内密度不随时间变化
C.容器内X、Y、Z的浓度之比为1︰2︰2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
参考答案:A
本题解析:略
本题难度:简单
3、选择题 在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A.反应混合物的浓度
B.反应体系的压强
C.反应物的转化率
D.正、逆反应的速率
参考答案:C
本题解析:对于一个前后气体系数不变的反应,当反应达到平衡时,增大体积,各物质浓度减小、压强减小,但是反应物和生成物的浓度变化相同,所以平衡不移动,所以A、B错误;若加入催化剂,正逆反应速率同倍数增大,所以平衡也不移动,D错误;若反应物的转化率变化,则平衡一定移动,故选C。
本题难度:一般
4、选择题 t℃时,在一密闭容器中充入2molA和3molB,发生如下化学反应:aA(g)+B(g) C(g)+D(g) 已知,平衡时,Ca(A)·C(B)= C(C)·C(D),然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则B的转化率是?(?)
C(g)+D(g) 已知,平衡时,Ca(A)·C(B)= C(C)·C(D),然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则B的转化率是?(?)
A. 60%? B. 40%? C. 4%? D. 无法确定
参考答案:B
本题解析:平衡时,Ca(A)·C(B)= C(C)·C(D),则平衡常数K=1。在温度不变的情况下,扩大容器容积至原来10倍,A的百分含量始终未有改变,这说明反应前后体积是不变的,因此α=1。设B的转化率是x,则生成C、D的物质的量都是3x。平衡时剩余A和B分别是2-3x、3-3x,所以 ,解得x=0.4,答案选B。
,解得x=0.4,答案选B。
本题难度:一般
5、选择题 25℃时,有关弱酸的电离平衡常数如下,则下列有关说法不正确的是(? )
弱酸化学式
| CH3COOH
| HCN
| H2CO3
|
电离平衡常数
| 1.8×10-5
| 4.9×10-10
| K1=4.3×10-7? K2=5.6×10-11
|
A.25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则
c(Na+)-c(CH3COO-)=9.9×10-7mol/L
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中, c(H+)相等.
C.25℃时,0.1mol/L的各溶液的pH关系pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
参考答案:C
本题解析:根据25℃时,若同浓度的醋酸和氢氧化钠等体积混合后生成醋酸钠,强碱弱酸盐显碱性。若溶液pH=8,则由c(OH-)×c(H+)="Kw" 和 PH=—lgC(H+)得
c(OH-)-c(H+)=9.9×10-7mol/L?由电荷守恒得c(Na+) + c(H+)? =c(OH_)+c(CH3COO-)
c(Na+)-c(CH3COO-)=9.9×10-7mol/L ,所以A正确;25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中, c(H+)相等,正确,因为 PH=—lgC(H+) ;NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)这是电荷守恒,所以D正确;
弱酸的电离平衡常数可以看到:醋酸最强,碳酸次之,接下来是氢氰酸,碳酸氢根最弱,所以他们对应的钠盐,PH 的大小关系是pH(Na2CO3)>(NaCN)>pH(CH3COONa),所以C错误。故选C。
点评:这是教学的重难点,也是考试的重点。弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度以其在化学方程式中的计量为幂的乘积,跟溶液中未电离分子的浓度以其在化学方程式中的计量为幂的乘积的比值,即溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值是一个常数,叫做该弱电解质的电离平衡常数。这个常数叫电离平衡常数,简称电离常数。只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
本题难度:简单