1、填空题 一定温度下,将2mol A和2mol B两种气体混合于体积为2 L的某恒容的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),
xC(g)+2D(g), <0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
<0,2min 末反应达到平衡状态(温度不变),生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)X的值等于_________,
(2)该反应的化学平衡常数K=_________,升高温度时K值将_________(填“增大”、“减小”、“不变”)
(3)A物质的转化率为_________。
(4)若维持温度不变,在原平衡混合物的容器中再充入3mol C和3mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为_________mol;达新平衡时,A的物质的量为n(A)=_________mol。
参考答案:(1)2
(2)0.5;减小
(3)60%
(4)3;2.6
本题解析:
本题难度:一般
2、选择题 在一定温度下,反应
H2(g)+X2(g)?HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5%
B.17%
C.25%
D.33%
参考答案:由一定温度下,反应12H2(g)+12X2(g)?HX(g)的平衡常数为10,
则相同条件下HX分解的化学反应的平衡常数为110,设HX分解的物质的量为x,则
? ?HX(g)?12H2(g)+12X2(g)
开始? 1.0mol/L? 0? 0
转化? x1mol/L? x2mol/L? x2mol/L
平衡? (1-x)mol/L?x2mol/L? x2mol/L
故x212×x212(1-x)=110,
解得x=0.17mol,
该温度时HX(g)的最大分解率为0.17mol1.0mol×100%=17%,
故选B.
本题解析:
本题难度:一般
3、选择题 在一定温度下,下列叙述不是可逆反应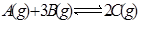 达到平衡的标志的是(?)
达到平衡的标志的是(?)
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)2v正(B)=3v逆(C);(5)混合气体的总压强不再变化;(6)混合气体的物质的量不再变化;(7)混合气体的平均相对分子质量保持不变时;(8)A、B、C的分子数目比为1:3:2。
A. (2)(8)? B. (7)(4)? C. (1)(3)? D. (5)(6)
参考答案:A
本题解析:化学平衡的标志是:① ;②各组分的物质的量、质量、含量保持不变。⑴正确⑵不正确,均为逆速率;⑶⑷⑸⑹⑺均正确;⑻不正确,A、B、C的分子数目比为1:3:2,不能说明正速率等于逆速率。选A。
;②各组分的物质的量、质量、含量保持不变。⑴正确⑵不正确,均为逆速率;⑶⑷⑸⑹⑺均正确;⑻不正确,A、B、C的分子数目比为1:3:2,不能说明正速率等于逆速率。选A。
本题难度:一般
4、填空题 恒温下,将3 mol N2与6 mol H2的混合气体通入一个体积为2L的密闭容器中,发生如下反应:N2 (g) + 3 H2(g)  2NH3(g),5min后达到平衡,平衡时生成NH3的物质的量为2.4mol???
2NH3(g),5min后达到平衡,平衡时生成NH3的物质的量为2.4mol???
(1)以NH3的浓度变化来表示的化学反应速率为_______
(2)N2的转化率为_______
(3)平衡混合气体中NH3的体积分数为_______
(4)反应前后容器内气体压强之比为 ________
参考答案:(1)?0.24 mol /L? ?
(2)?40%? ?
(3)?36.4%?
(4)? 15:11
本题解析:
本题难度:一般
5、填空题 (本题共8分)将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g) CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
(1).用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是_____________________。?
(2).当改变反应的某一个条件,平衡一定向正反应方向移动的是__________。
a.逆反应速率先增大后减少? b.正反应速率先增大后减少
c.某反应物的体积百分含量减小? d.化学平衡常数K值增大
(3).达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是?(填序号)。

A.P3>P2T3>T2
B.P2>P4T4>T2
C.P1>P3T1>T3
D.P1>P4T2>T3