1、选择题 已知R原子有b个中子,R2+核外有a个电子。表示R原子符号正确的是(? )
参考答案:C
本题解析:R原子有b个中子,R2+核外有a个电子,则原子核外的电子数是a+2,质子数是a+2,所以表示R原子符号正确的是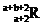 ,故选项的C。
,故选项的C。
本题难度:一般
2、选择题 我国科学家最近发现一种只有六个中子构成的粒子,这种粒子称为“六中子”,也有人称之为“零号元素”。下列有关“六中子”粒子的说法不正确的是
A.该粒子不显电性
B.该粒子质量数为6
C.在周期表中与氢元素占同一位置
D.该粒子质量比氢原子的大
参考答案:C
本题解析:由于该未来的质子数为是0,所以不可能和氢元素在同一个位置,C不正确,其余都是正确的,答案选C。
本题难度:简单
3、选择题 第ⅤA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上一周期,当A的原子序数为x时,B的原子序数为
( )。
A.x-18? B.x-8? C.x+8? D.x+18
参考答案:A
本题解析:据题意可知A、B在周期表中的相对位置为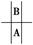 ,且在第ⅤA族,A所在周期元素种类数为18,所以B的原子序数应为x-18。
,且在第ⅤA族,A所在周期元素种类数为18,所以B的原子序数应为x-18。
本题难度:一般
4、选择题 下列叙述正确的是
A.第三周期元素的离子半径从左到右逐渐减小
B.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
C.ⅦA族元素的气态氢化物中,稳定性最好的其沸点也最高
D.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
参考答案:C
本题解析:A选项中若比较钠离子的半径和氯离子的半径,则氯离子半径大于钠离子,不符合。B选项需先确定是同周期才能比较;C选项稳定性最好的是氟化氢,其沸点也最高,还需考虑到氢键的存在,正确。D选项氟和氧的最高化合价为0价,不等于族序数。
点评:本题涉及到了金属性、非金属性的比较;半径的比较,稳定性、沸点、最高正化合价的知识,都是元素周期律的基本知识点。归根结底是比较元素的金属性和非金属性,利用元素周期律来比较,处理好位、构、性三者之间的关系
本题难度:简单
5、填空题 (10分)现有A、B、C、D四种短周期主族元素,其原子序数依次增大,已知A、C位于同一主族,A元素在元素周期表中原子半径最小,B、D原子最外层电子数相等,且B、D原子序数之和是A、C原子序数之和的两倍。
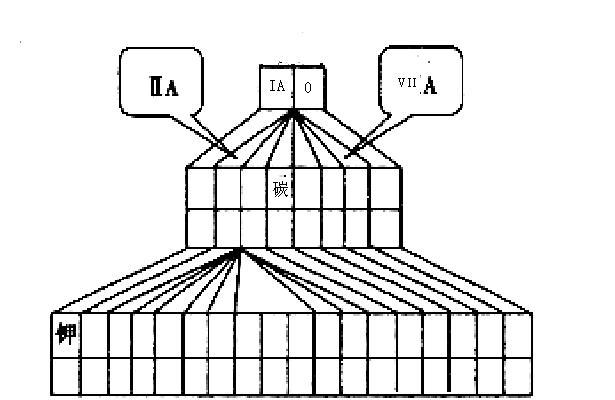
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出A、B、C、D四种元素的元素符号。
(2)图中将过渡元素涂黑。
(3)由上述四种元素中的某几种所形成的具有漂白作用物质的化学式(写出两种):_______、______。
参考答案:如图所示
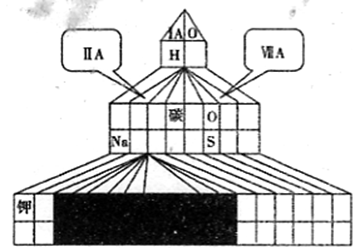
(2)SO2、Na2O2、 H2O2
本题解析:略
本题难度:简单