1、选择题 现有X、Y、Z、W四种短周期元素,原子半径:r(X)>r(Y)>r(Z)>r(W)。X、Y、Z处于同一周期,Z、W处于同一主族;X、Y、Z的原子序数之和为40。下列说法中正确的是(?)
A.Y的最高价氧化物对应的水化物一定是强碱
B.Z一定位于第三周期ⅦA族
C.若X、Y、W可形成化合物XYW2,则该化合物的水溶液呈碱性
D.X与足量的W加热反应会生成化合物X2W
参考答案:C
本题解析:
正确答案:C
W―O,X―Na,Y―Al,Z―S或W―F,X―Na,Y―Mg,Z―Cl或W―N,X―Na,Y―Si,Z―P等多种组合
A、不正确,可能是弱碱或酸;B、不正确,Z不一定位于第三周期ⅦA族;C、正确,NaAlO2,水解后呈碱性;D、不正确,不一定形成Na2O。
本题难度:一般
2、选择题 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X所处的周期序数与族序数相等。下列说法错误的是( )
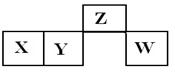
A.Z的氧化物与W的氧化物的化学键类型相同
B.X、Z的氧化物都能溶于氢氧化钠和稀硫酸溶液中
C.最高价氧化物对应水化物稀溶液的氧化性:W<Z
D.Y原子的半径比W原子的半径大
参考答案:B
本题解析:由题意推断出:X为铝,Y为硅,Z为氮,W为硫,A、都是共价键,正确;B、氧化铝是两性氧化物,可以,氮的氧化物是酸性氧化物与稀硫酸不反应,错误;C、稀硝酸的氧化性大于稀硫酸,正确;D、硅的原子半径大于硫的原子半径,正确。
本题难度:一般
3、选择题 下列事实中,能说明氯的非金属性比硫强的是
A.高氯酸的酸性比亚硫酸强
B.次氯酸的氧化性比稀硫酸强
C.氯化氢比硫化氢的热稳定性好
D.氯原子最外层电子数比硫原子多
参考答案:C
本题解析:A、依据最高价含氧酸的酸性判断非金属性的强弱,高氯酸应与硫酸作比较,错误;B、应比较其简单阴离子的还原性来比较非金属性的强弱,错误;C、利用气态氢化物的稳定性来比较非金属性的强弱,正确;D、依据得电子的难易来比较非金属性的强弱,而不是最外层电子的多少,错误,答案选C。
本题难度:一般
4、选择题 下列各表中的数字代表的是元素的原子序数,表中数字所表示的元素与它们在周期表中的相对位置相符的是
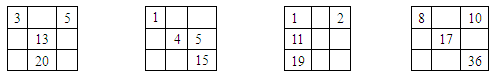
A.? B.? C.? D.
参考答案:D
本题解析:A.5元素B与13号元素Al是同一主族的元素,而20号元素与Al不在同一主族。错误。.5元素B与15号元素P不是同一主族的元素。错误。1号元素H与11号元素Na在元素周期表中分别位于第一、第三周期的第ⅠA。二者并不相邻。错误。D.给出的元素的原子序数与元素在周期表中的位置相符合。正确。
本题难度:一般
5、填空题 (12分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
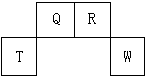
(1)W在周期表中的位置是_________________, Q、R、T三种元素原子的半径从大到小排列顺序__________ (用元素符号表示),Q的最高价氧化物的电子式_____________,R气态氢化物分子的结构式为_____________。
(2)元素的原子得电子能力:Q______W(填“强于”或“弱于”)。
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点?(填“高”或“低”)于R的的常见气态氢化物。
(4)T、Q、R、W的单质中,固态时属于原子晶体的是_____________(填名称)。
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在上表中的对应编号__________,与T同周期且最高价氧化物的水化物碱性最强的元素在上表中的对应编号____________,编号为⑥的最高价氧化物的水化物的电子式?。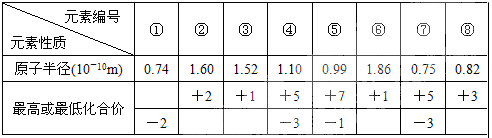
参考答案:(1)第三周期VIA族? Al>C>N?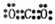 ?
?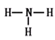
(2)弱于?(3)低?(4)金刚石(5)⑦?⑥?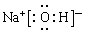
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知,T属于第三周期,T所处的周期序数与主族序数相等,所以T是铝。则Q是C,R是N,W是S。
(1)同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大。所以原子半径是铝>碳>氮。CO2和NH3均是由极性键形成的共价化合物,其电子式和结构式分别为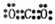 、
、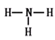 。
。
(2)非金属性越强,越容易得到电子,所以碳原子的得电子能力弱于硫原子的。
(3)原子序数比R多8的元素是P,其氢化物的沸点要低于氨气的,因为氨气中存在氢键。
(4)碳的同素异形体中的金刚石属于原子晶体。
(5)N属于第二周期第ⅤA,最高价是+5价,最低价是-3价,在该族中氮原子的半径最小,所以是⑦。与T同周期且最高价氧化物的水化物碱性最强的元素是Na,最高价是+1价,没有负价,且在同周期中钠原子半径增大,所以是⑥。编号为⑥的最高价氧化物的水化物是氢氧化钠,所以离子化合物,但还含有极性键,电子式为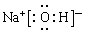 。
。
本题难度:一般