1、选择题 下列化学用语,正确的是(?)
A.双氧水使酸性KMnO4溶液的红色褪去:3H2O2+2MnO4-+6H+===2Mn2++4O2↑+6H2O
B.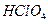 的电离方程式:
的电离方程式: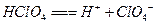
C.电解氢氧化钠溶液铁作阳极的电极方程式为: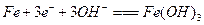
D.表示中和热的热化学方程式:2NaOH(aq)+H2SO4(aq) ===Na2SO4(aq)+2H2O(l)
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列离子方程式正确的是
[? ]
A.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒乙酸与碳酸钠溶液反应:2H++CO32-== CO2↑+H2O
B.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O
C.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O 2C6H5OH+CO32-
2C6H5OH+CO32-
D.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒甲醛溶液与足量的银氨溶液共热 HCHO+4[Ag(NH3)2]++4OH- CO32-+2NH4++4Ag↓+6NH3+2H2O
CO32-+2NH4++4Ag↓+6NH3+2H2O
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列离子方程式正确的是( )
A.硫酸钠溶液和氯化钡溶液反应:Ba2++SO42-═BaSO4↓
B.铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag
C.铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
D.碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O
参考答案:A.硫酸钠溶液和氯化钡溶液反应的离子反应为Ba2++SO42-═BaSO4↓,故A正确;
B.铜和硝酸银溶液反应的离子反应为Cu+2Ag+═Cu2++2Ag,故B错误;
C.铁和稀硫酸反应的离子反应为Fe+2H+═Fe2++H2↑,故C错误;
D.碳酸钙与稀盐酸反应的离子反应为CaCO3+2H+═CO2↑+H2O+Ca2+,故D错误;
故选A.
本题解析:
本题难度:简单
4、简答题 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:
(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为______(填化学式);
(2)完成下列过程中的离子反应方程式:
O→C______;D→E______;E→F______;
(3)B值是多少mol?写出计算过程.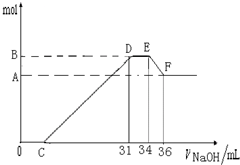
参考答案:(1)HNO3的还原产物有N2O,NO,NO2,NH4+等,其中,铵根可以保留在溶液中,且可以与氢氧化钠反应,D与E一段氢氧化钠被消耗,但没有和氢氧化铝反应,从题干中可以知道,硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵.
故答案为:NH4NO3;
(2)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O,
D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为,NH4++OH-═NH3?H2O,
E与F之间沉淀的量减少,肯定是因为Al(OH)3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
故答案为:H++OH-═H2O;NH4++OH-═NH3?H2O;Al(OH)3+OH-=AlO2-+2H2O;
(3)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,
其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
氢氧化铝与氢氧化钠物质的量之比为1:1,
EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,
Al(OH)3+NaOH→NaAlO2+2H2O
1?mol? 1mol
0.008?mol? 0.008mol
Al(OH)3的量是0.008mol,所以Al3+也是0.008mol.
所以B与A差值为0.008mol
然后看D与E一段氢氧化钠被消耗,
但没有和氢氧化铝反应,从题干中可以知道
硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵.
DE段分析如下,是NH4NO3和NaOH反应
NH4NO3~NaOH
1 mol?1mol
n(NH4NO3)=n(NaOH)=(34-31)×10-3L×4mol/L=0.012mol 所以铁和铝开始和硝酸反应的时候生成三价离子,N元素变成铵根离子
铁离子和铝离子失去3e,N元素从+5变成-3价得8e
设铁有xmol,Al离子也是0.008mol,NH4+有0.012mol,根据电子守恒可得:
3x+0.008×3=0.012×8
x=0.024mol,
所以铁离子有0.024mol,那么氢氧化铁有0.024mol,氢氧化铝0.008mol,
则沉淀量最多的时候是0.032mol,
答:B值是0.032mol.
本题解析:
本题难度:一般
5、选择题 下列化学反应的离子方程式不正确的是?(?)
A.铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
B.Fe(OH)3溶于过量的HI溶液:2Fe(OH)3+6H++2I━=2Fe2++I2+6H2O
C.在AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.过量的NH4HSO4溶液与Ba(OH)2溶液反应:2H++SO42━+Ba2++2OH━=BaSO4↓+2H2O
参考答案:A
本题解析:略
本题难度:一般