1、选择题 下列离子方程式正确的是(?)
A.氯化铁溶液中加入过量氨水 Fe3++ 3OH- = Fe(OH)3↓
B.钠与水的反应 Na + 2H2O = Na++2OH-+H2↑
C.碳酸钙溶于稀盐酸中 CO32-+2H+=H2O+CO2↑
D.氧化镁与稀盐酸混合:MgO + 2H+= Mg2++ H2O
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下列离子方程式正确的是
A.碳酸钙溶于稀盐酸:CO32―+2H+=CO2↑+H2O
B.铝和稀硫酸反应:Al+3H+=Al3++3H2↑
C.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
D.氯化镁溶液跟NaOH溶液反应:Mg2++2OH-=Mg(OH)2↓
参考答案:D
本题解析:A项碳酸钙难溶不能拆开,B项电荷不守恒,应该是:2Al+6H+=2Al3++3H2↑;C项铜跟硝酸银溶液反应,电荷不守恒,应该是:Cu+2Ag+=Cu2++2Ag;D项正确。
点评:离子方程式的书写经常要检查拆开的物质是否能拆,是否符合三个守恒关系。
本题难度:简单
3、选择题 下列的离子方程式正确的是
A.用大理石跟稀盐酸制二氧化碳:CO32-+ 2H+ = H2O + CO2↑
B.稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑
C.H2SO4溶液中滴入Ba(OH)2溶液:OH- + H+=H2O
D.氧化镁与盐酸混合:MgO + 2H+ = Mg2+ + H2O
参考答案:D
本题解析:A、用大理石跟稀盐酸制二氧化碳的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;B、银与稀硫酸不反应;C、H2SO4溶液中滴入Ba(OH)2溶液的离子方程式:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O; D正确。
本题难度:一般
4、选择题 下列离子方程式正确的是 (?)
A.用浓盐酸与二氧化锰反应制取少量氯气:
MnO2 + 4H+ +2Cl—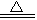 Mn2+ +Cl2↑ + 2H2O
Mn2+ +Cl2↑ + 2H2O
B.铜与稀硝酸反应: Cu+4H++2NO3-==Cu2++2NO↑+2H2O
C.硅酸钠溶液中通人过量二氧化碳:
SiO32-+2CO2+2H2O = H2SiO3↓+2HCO3-
D.氟气与溴化钠溶液反应:F2+2Br—====2F—+Br2
参考答案:AC
本题解析:A正确,B不正确,电子得失不守恒,应该是3 Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;C正确,D不正确,单质氟通入水溶液中,立即和水反应,得不到单质溴,答案选AC。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:一般
5、简答题 A、B、C、D、E、F为原子序数依次增大的六种元素,其中除F外均为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E、F的单质均为固体,且F单质是目前世界上使用量最大的金属.A是所有元素中原子半径最小的元素,C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个.请用化学用语回答下列问题:
(1)C的离子结构示意图为______;D与E两元素的离子半径:D______E(填“>”、“<”或“=”).
(2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为______.
(3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为______.
(4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH______7(填“>”、“<”或“=”).化合物AB3是一种无色的液态物质,受撞击会分解成两种单质,请写出该反应的化学方程式______.
(5)已知一定条件下,D单质与氧化物F3O4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式______.
(6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl2溶液,也有白色沉淀产生.则该复盐的化学式为______.
参考答案:常温下A、B、C的单质均为无色、无味的气体,常见单质均为无色无味的气体有H2、N2、O2;F单质是目前世界上使用量最大的金属,说明F为铁;A是所有元素中原子半径最小的元素,说明A是氢元素;C与E同主族,且E的原子序数为C的2倍,在主族中只有氧和硫,氧的原子序数为8,硫的原子序数为16;D的最外层电子数比最内层多1个,A、B、C、D、E、F为原子序数依次增大的六种元素,C为氧,说明D在第三周期,则D原子的核外有三个电子层,第一电子层排2个电子,最外层即第三层应排3个电子,则核外电子数为13,即为铝.故A为H、B为N、C为O、D为Al、E为S、F为Fe.
(1)氧原子最外层排布6个电子,得到两个电子后形成O2-,O2-离子结构示意图为
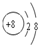
.微粒半径大小比较看电子层数,电子层数越多,半径越大,D离子是Al3+与E离子是S2-,Al3+离子结构示意图为
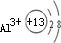
,S2-离子结构示意图为
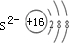
,Al3+核外2个电子层,S2-核外3个电子层,故离子半径:Al3+<S2-,
故答案为:
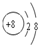
;<;
(2)A是氢元素,由H与碳元素组成的原子个数比3:1的化合物的最简式为CH3,再结合烷烃通式:CnH2n+2分析:
设该化合物的分子式为(CH3)n,n=1,分子式为CH3,不符合烷烃通式;n=2,分子式为C2H6,为乙烷,符合烷烃通式;n=3,分子式为C3H9,不符合烷烃通式;故可确定该化合物为乙烷C2H6,结构简式为CH3-CH3.
故答案为:CH3-CH3;
(3)H与O形成的10电子阴离子是OH-,H与S形成的18电子阴离子是HS-,HS-是酸式根离子,可与OH-反应,反应的离子方程式为HS-+OH-═S2-+H2O,
故答案为:HS-+OH-═S2-+H2O;
(4)B是N元素,氮的最高价氧化物的水化物是HNO3,氮的氢化物是NH3,HNO3与NH3反应生成的盐是NH4NO3,为强酸弱碱盐.根据盐类水解原理解题,强酸弱碱盐水解呈酸性,所以NH4NO3水溶液呈酸性,pH<7.
化合物AB3是HN3,根据题意,受撞击会分解成两种单质,只能是H2和N2.根据反应物和生成物写出方程式再配平即得2HN3═H2↑+3N2↑,
故答案为:<;2HN3=H2↑+3N2↑;
(5)D单质是Al,与氧化物F3O4反应时,放出大量的热且使Fe单质熔化,该反应为铝热反应,根据反应物和生成物写出方程式再配平即得8Al+3Fe3O4?高温?.?4Al2O3+9Fe,
故答案为:8Al+3Fe3O4?高温?.?4Al2O3+9Fe;
(6)复盐指由两种阳离子和一种酸根离子组成的盐,向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解,说明含有Al3+,反应为Al3++3OH-═Al(OH)3↓、
Al(OH)3+OH-═AlO2-+2H2O.同时有刺激性气味的气体放出,说明含有NH4+,反应为NH4++OH-═NH3?H2O.加入盐酸酸化的BaCl2溶液,也有白色沉淀产生,说明酸根离子是SO42-,反应为
SO42-+Ba2+═BaSO4↓.故该复盐中含NH4+、Al3+、SO42-.根据三种离子个数比为1:1:2,结合化合价代数和等于零即可确定该复盐的化学式为NH4Al(SO4)2,
故答案为:NH4Al(SO4)2.
本题解析:
本题难度:一般