1、选择题 已知标况下氯气和氢气的混合气体共22.4L,经过点燃充分反应之后,将反应后的混合气体通入氢氧化钠溶液中,反应完全后,共消耗氢氧化钠1.5mol,求原混合气体中氯气和氢气的体积比(?)
A.2:1
B.1:1
C.1:2
D.3:1
参考答案:D
本题解析:氢气和氢氧化钠溶液不反应,这说明在反应中氢气不能过量。设氢气的物质的量是xmol,这氢气反应的氯气是xmol,生成氯化氢是2xmol。过量的氯气是1mol-xmol-xmol,即和氢氧化钠溶液反应的氯气是1mol-2xmol,则根据反应式H2+Cl2=2HCl、HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O可知,2x+2-4x=1.5,解得x=0.25mol,则氯气是0.75mol,所以混合气体中氯气和氢气的体积比3:1,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的训练,有利于提高学生的逻辑推理能力。该题的关键是明确反应的原理,然后结合方程式灵活运用即可。
本题难度:简单
2、计算题 在一定量的石灰乳中通入一定量的氯气,二者 恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的 曲线如下图所示。
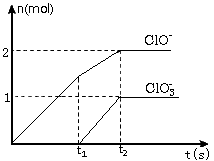
(l)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为___。
(2)该石灰乳中含有Ca(OH)2的物质的量是____mol。
(3)据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通入氯气的速度不同,ClO-和ClO3-的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后___2(填“>”“<” 或“=”);若,则,n(Cl-)=____mol(用含a的代数式来表示)。
参考答案:(1)10Ca(OH)2+10Cl2=7CaCl2+2Ca(ClO)2+ Ca(ClO3)2+10H2O
(2)5
(3)< ;5(5+a)/(3+a)
本题解析:
本题难度:一般
3、选择题 下列关于液氯、新制氯水叙述中不正确的是( )
A.都具有酸性
B.都能使湿润的有色布条褪色
C.都含Cl2
D.液氯是纯净物,而新制氯水是混合物
参考答案:A
本题解析:液氯是一种纯净物,没有酸性,都可使湿润的有色布条褪色。新制氯水中有多种微粒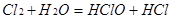 ,是混合物。答案为A .
,是混合物。答案为A .
本题难度:简单
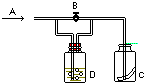
4、选择题 如图所示,A处通入Cl2,关闭B阀时,C处红色布条无变化;?打开B阀时,C处红色布条褪色,则D中的溶液是( )
A.浓H2SO4
B.H2O
C.NaOH溶液
D.饱和食盐水