1、选择题 不能与溴水发生反应的是 ①苯? ②苯酚? ③亚硫酸? ④NaOH溶液? ⑤AgNO3溶液? ⑥裂化汽油? ⑦己烷? ⑧镁粉
A.①⑦
B.只有①
C.①⑦⑧
D.①②⑤⑦
参考答案:A
本题解析:溴水主要与不饱和有机物发生加成反应,如⑥;与含酚羟基的物质发生取代反应,如②;溴水还具有氧化性,可以与还原性物质发生氧化还原反应,如③⑧;还有酸性,可以与碱反应,如④,有溴离子,可以与银离子发生沉淀反应,如⑤;不能与苯或己烷反应,这类物质发生反应必须是纯溴。
点评:总结溴水的化学性质,有助于进一步理解有机反应。属于较综合性习题。
本题难度:简单
2、选择题 已知电解熔融氯化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙。请你根据已学知识,按下图箭头所表示的物质间可能发生的转化,分析下列说法中正确的是
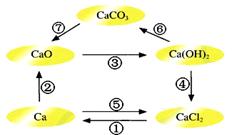
A.CaO、Ca(OH)2、CaCO3都含有氧元素,所以CaO、Ca(OH)2、CaCO3都属于氧化物
B.电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应
C.往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液都能实现反应⑥的转化
D.工业上可通过反应④往石灰乳中通入氯气生产漂白粉,所得漂白粉的主要成分为CaCl2
参考答案:C
本题解析:由2种元素组成的,其中一种是氧元素的化合物是氧化物,因此氢氧化钙和碳酸钙不是氧化物,A不正确;电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是分解反应,B不正确;氢氧化钙和碳酸钠以及碳酸氢钠都反应生成碳酸钙白色沉淀,C正确;漂白粉是由氯化钙和次氯酸钙构成的,其有效成分是次氯酸钙,D不正确,答案选C。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导,有利于提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
3、选择题 将按等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,再滴入含有品红和Ba(NO3)2的混合溶液,则发生的实验现象是( )
A.红色溶液很快褪色
B.红色溶液不褪色
C.有白色沉淀生成
D.溶液仍然透明
参考答案:等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,发生:SO2+Cl2+2H2O=2HCl+H2SO4,则
A.生成HCl和H2SO4,不具有漂白性,不能使红色溶液褪色,故A错误;
B.具有漂白性的SO2和Cl2因发生反应生成HCl和H2SO4,而不具有漂白性,故B正确;
C.因生成H2SO4,和Ba(NO3)2反应生成BaSO4沉淀,故C正确;
D.因生成BaSO4沉淀,则溶液浑浊,故D错误.
故选BC.
本题解析:
本题难度:一般
4、实验题 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
一、定性研究:
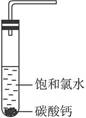
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请完成下列问题:
(1)反应后所得的溶液漂白性增强的原因是____________________________________。
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有_________。
二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150 mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请完成下列问题:
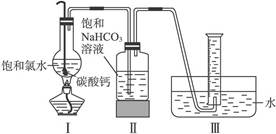
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是____________________________________________________。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况下的CO2气体B L,发现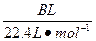 明显小于
明显小于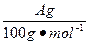 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是____________________________________。
参考答案:(1)CaCO3消耗了氯水中的HCl,使Cl2+H2O HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大
(2)Ca(HCO3)2
(3)在导管末端再连接长导管,使导管的出口接近量筒底部
(4)碳酸钙与CO2反应生成的Ca(HCO3)2使生成CO2的物质的量小于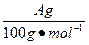
(5)从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集
本题解析:本题是探索性的实验,研究定性和定量的问题和平衡移动的知识及观察能力、误差分析能力。
由于CaCO3消耗了氯水中的HCl,使Cl2+H2O HCl+HClO平衡向右移动,HClO浓度增大。过量的碳酸钙与释放出的CO2在水中反应生成Ca(HCO3)2。发现
HCl+HClO平衡向右移动,HClO浓度增大。过量的碳酸钙与释放出的CO2在水中反应生成Ca(HCO3)2。发现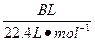 明显小于
明显小于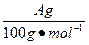 ,原因是CO2并没有完全释放出去。由Ⅰ到Ⅱ会有水蒸发出去,那么在Ⅱ中冷却,所以Ⅱ中的液体增多了。
,原因是CO2并没有完全释放出去。由Ⅰ到Ⅱ会有水蒸发出去,那么在Ⅱ中冷却,所以Ⅱ中的液体增多了。
本题难度:简单
5、选择题 用氯气消毒的自来水配制下列溶液时不会使配得的溶液变质的是(?)
A.NaOH
B.AgNO3
C.KNO3
D.FeCl2
参考答案:C
本题解析: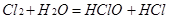 、碱和酸中和, AgNO3?结合氯离子生成沉淀,FeCl2
、碱和酸中和, AgNO3?结合氯离子生成沉淀,FeCl2
被次氯酸氧化成三价的铁。
本题难度:简单