1、选择题 下列关于氯水的叙述中,正确的是( )
A.新制氯水中没有分子,只有离子
B.新制氯水在光照的条件下,可以产生气体,该气体是氯气
C.新制氯水中滴加硝酸银溶液,没有任何现象
D.氯气可以使湿润的有色布条褪色
参考答案:A.氯气微溶于水,氯气与水反应:Cl2+H2O=H++Cl-+HClO,新制氯水中含有Cl2、H2O和HClO等分子,故A错误;
B.HClO具有不稳定性,光照条件下分解生成氧气,故B错误;
C.氯气与水反应:Cl2+H2O=H++Cl-+HClO,加入AgNO3溶液,会有白色沉淀产生,故C错误;
D.HClO具有强氧化性和漂白性,加入有色布条,有色布条褪色,故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
A? HI、HClO? B? HCl 、HIO? C? HClO3、HIO? D? HClO、HIO
参考答案:B
本题解析:氯化碘中碘为+1价,氯为-1价,与水反应可以看成为水解反应,Cl和H结合成HCl,I和OH结合,成HIO。故答案为B。
本题难度:一般
3、选择题 化学与科学、技术、社会、环境密切相关。下列说法不正确的是
A.SiC的硬度很大,可用作砂纸、砂轮的磨料
B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
C.常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
D.过氧化钠能与二氧化碳反应产生氧气,可用作高空飞行或潜水的供氧剂
参考答案:C
本题解析:略
本题难度:一般
4、实验题 某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应
 来制取并收集氯气,实验装置如图所示。
来制取并收集氯气,实验装置如图所示。
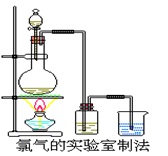

 ⑴写出该反应的化学方程式:?
⑴写出该反应的化学方程式:?
 ⑵上述反应中,盐酸表现出性质是?。
⑵上述反应中,盐酸表现出性质是?。
 (3)实验开始时,某学生对实验装置进行了气密性检查,
(3)实验开始时,某学生对实验装置进行了气密性检查,
 方法是?
方法是?

 (4)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是?。
(4)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是?。
 A.NaOH 溶液? B.Na2CO3溶液? C.浓硫酸
A.NaOH 溶液? B.Na2CO3溶液? C.浓硫酸
 (5)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气体积?(填大于、小于或等于)2.24L,原因是?
(5)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气体积?(填大于、小于或等于)2.24L,原因是?
 ?
?
参考答案:⑴ MnO2+4HCl(浓)=△=MnCl2+2H2O+Cl2↑?(2分)
⑵酸性?还原性?(2分)
(3)关闭分液漏斗的活塞,用酒精灯微热烧瓶时可以看到插入烧杯中的导管口有气泡,停止加热后插入烧杯中的导管中形成液柱,说明气密性良好。(2分)
(4)C?(2分)
(5)小于(2分)?随着反应的进行,氯化氢不断消耗及挥发,使浓盐酸变成稀盐酸,反应停止,氯化氢不能反应完。(2分)
本题解析:⑴实验室采用浓盐酸在二氧化锰的催化加热条件下来制备氯气,该反应的化学方程式为:MnO2+4HCl(浓)=△=MnCl2+2H2O+Cl2↑,⑵从这条反应方程式可以看出盐酸所表现的性质是酸性和还原性;(3)实验开始时,必须检验该装置的气密性,其可以采用的方法为:关闭分液漏斗的活塞,用酒精灯微热烧瓶时可以看到插入烧杯中的导管口有气泡,停止加热后插入烧杯中的导管中形成液柱,说明气密性良好;(4)因为浓硫酸并不会吸收氯气,故不能用浓硫酸来吸收氯气,故本题的答案选择C;(5)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,可以收集到标准状况下的氯气的体积小于2.24L,这是随着反应的进行,氯化氢不断消耗及挥发,使浓盐酸变成稀盐酸,反应停止,氯化氢不能反应完。
点评:本题考查了氯气的制备实验,该实验是高中的经典实验之一,本题考查的都是学生比较熟悉的知识点,该题难度中等。
本题难度:一般
5、选择题 实验室用MnO2与浓HCl反应制Cl2,若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属镁粉的反应。每个虚线框表示一个单元装置,其中错误的是
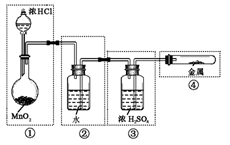
A.只有①和②处
B.只有②处
C.只有①、②和③处
D.①、②、③、④处
参考答案:D
本题解析:①错,二氧化锰与浓HCL反应需要加热;②错,洗气装置的导气管应长进短出;③错,导气管应长进短出;④错,试管口不能用橡皮塞塞紧;
本题难度:简单