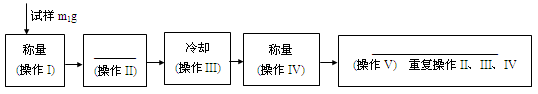
1、实验题 下面的框图是测定CuSO4·xH2O中结晶水含量的实验流程。
 ?
?
40. 填写流程中空白的操作名称:(操作II)_____________; (操作V)___________________。
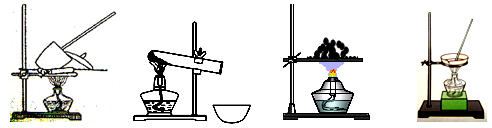
41. 其加热装置正确的是____________(填写编号)。
a? b?c?d
42. 重复操作II、III、IV,直到连续两次称量结果相差不超过______g。
43. 操作III必须要在_______(填仪器名称)中进行。
44. 以下胆矾结晶水含量的测定操作正确的是____________(填写编号)。
a. 加热时,晶体溅出坩埚,再加些胆矾
b. 加热时,先用小火,后用大火加热至最后
c. 加热时,不断用玻璃棒搅拌
45. 若实验测得的硫酸铜晶体中结晶水含量偏高,可能的原因有__________(填写编号,下同);若实验测得的硫酸铜晶体中结晶水含量偏低,可能的原因有____________。
a.晶体未完全变白就停止加热?
b.加热过程中有少量晶体溅出
c.加热后在空气中自然冷却
参考答案:40. 加热;恒重。41. a。42. 0.001。43.干燥器;44. c。45. b;a、c。
本题解析:40.操作III是冷却,故操作II加热;操作V为检测水是否全部失去,要求质量不再变化,故为恒重。
41. 固体加热需要坩埚,装置为a。
42. 重复操作II、III、IV,直到连续两次称量结果相差不超过电子天平的可读数位0.001g。
43. 操作III必须要在干燥器中进行,防止在空气中冷却时CuSO5吸水。
44. a. 加热时,晶体溅出坩埚,再加些胆矾,不能确定是否与损失的一致,不正确;b. 加热时,先用小火,后用大火加热至最后。CuSO5高温分解,故不正确;c.加热时,不断用玻璃棒搅拌,防止受热不均匀而飞溅,正确。
45. a.晶体未完全变白就停止加热,仍含有水,故测定的结晶水含量偏低;b.加热过程中有少量晶体溅出,溅出CuSO5当做水了,故测定的结晶水含量偏高;c.加热后在空气中自然冷却,CuSO5吸水,故测定的结晶水含量偏低。4·xH2O中结晶水含量的实验分析与评价。
本题难度:一般
2、选择题 下列实验操作或说法中错误的是(双选)( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
参考答案:AD
本题解析:试题分析:A选项,乙醇因为与水互溶,不能作为水体系的萃取剂。D选项,萃取操作时,对萃取剂的要求:一是和原溶剂互不相溶且不反应,与溶质也不能反应;二是溶质在萃取剂中的溶解度要大于在原溶剂中的溶解度;三是萃取剂与原溶剂密度有差异,但其密度不一定比水大,所以答案选AD。
考点:考查化学实验基本操作的有关判断
点评:该题是常识性知识的考查,主要是考查学生对常见仪器使用以及常见化学实验原理的熟悉了解程度,主要是有利于培养学生规范严谨的实验操作动手能力,提升的学生学科素养,激发学生的学习兴趣和学习积极性。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
3、简答题 综合利用海水资源是一个重要的研究课题,如图1是工业上用海水制备食盐、纯碱、金属镁、溴等物质的一种流程:

完成下列填空
(1)气体X是______(填化学式)
(2)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加______.
(3)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为______.
(4)由MgCl2?6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如图2:
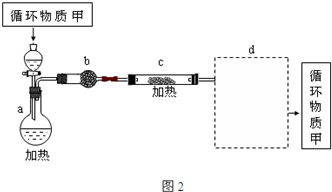
①图2中,装置a由______、______、双孔塞和导管组成(填仪器名称).
②循环物质甲的名称是______.
③制取无水氯化镁必须在氯化氢存在的条件下进行,主要原因是______.
④图2装置b中填充的物质可能是______(填写编号).
e.硅胶f.碱石灰g.无水氯化钙h.浓硫酸
⑤图2方框中的d装置可选择______(填写编号)
参考答案:(1)由于氨气极易溶于水而二氧化碳微溶于水,为得到大量的碳酸氢钠,应先通入氨气,故答案为:NH3;
(2)氯离子的检验方法:取少量试样溶于水后,再滴加硝酸酸化的硝酸银,看是否有白色沉淀生成,故答案为:HNO3、AgNO3;
(3)氯气具有氧化性,其氧化性强于溴单质,氯气能氧化溴离子,反应实质为:Cl2+2Br-═Br2+2Cl-,故答案为:Cl2+2Br-═Br2+2Cl-;
(4)①装置用到的仪器有:圆底烧瓶、分液漏斗、双孔塞和导管,故答案为:圆底烧瓶、分液漏斗;
②氯化镁易水解,应在氯化氢气流中获得其晶体,氯化氢可以循环使用,故答案为:盐酸;
③如果直接在空气中加热MgCl2?6H2O则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解,故答案为:抑止Mg2+的水解;
④酸性气体的干燥必须用酸性干燥剂或中性干燥剂,在选项中,硅胶是酸性干燥剂,碱石灰是碱性干燥剂,能和酸性物质反应,无水氯化钙是中性干燥剂,浓硫酸是酸性干燥剂,但是液体,不能装入b中,故答案为:eg;
⑤氯化氢极易溶于水或强碱,药要防止倒吸,只有AD符合,故答案为:AD.
本题解析:
本题难度:一般
4、选择题 下列有关实验原理、方法和结论都正确的是
A.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
B.取少量X溶液,加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42-
D.某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+无K+
参考答案:A
本题解析:A.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,这说明气体一定是氨气,所以一定有NH4+,A正确;
B.取少量X溶液,加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中可能含有Fe2+,也可能含有铁离子,B不正确;
C.向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则原溶液中可能含SO42-,也可能含有Ag+,C不正确;
D.某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+,但不能确定是否含有K+,乙烷没有透过蓝色的钴玻璃观察,D不正确,答案选A。
点评:该题是中等难度的试题,试题综合性强,对学生的思维能力要求高,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。该类试题需要明确的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般
5、选择题 除去NaCl中混有的 MgCl2、Na2SO4时选用试剂依次为(?)
A.NaOH、BaCl2、Na2CO3、HCl
B.Ca(OH) 2、Mg(NO3) 2、Na2CO3、HCl
C.NaOH、Ba(NO3) 2、Na2CO3、HCl
D.Na2CO3、BaCl2、HCl
参考答案:A
本题解析:除去杂质的原则是“不增、不减”。即不增加新的杂质,不减少被提纯的物质。首先要考虑选用哪种除杂剂MgCl2用NaOH, 除去Na2SO4,然后考虑加入的顺序,接着考虑除杂剂的量的多少为了将杂质除尽,就要过量;最后再考虑将过量的除杂剂除去。正确选项为A.
本题难度:一般