1、选择题 实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是
A.少量Na2SO4固体,v(H2)减小
B.VmLBaCl2溶液,v(H2)不变
C.加入细小的碳粒,v(H2)增大
D.加入NH4HSO4固体,v(H2)不变
参考答案:C
本题解析:A中速率不变,错误;B加入了溶液相当于稀释了,故速率减小,错误;C选项中形成了原电池,加快了反应速率,速率增大,正确;D选项增加了氢离子浓度,速率加快,错误。
本题难度:一般
2、选择题 化学中常用图象直观地描述化学反应的进程或结果,下列图象描述正确的是( )

A.图①可以表示对某化学平衡体系使用催化剂后反应速率随时间的变化
B.图②表示压强对反应2A(g)+B(g)=3C(g)+D(s)的影响,且甲的压强大
C.图③电镀时,铜片与直流电源的负极相连
D.图④滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用外加保护膜的细铁棒做笔在滤纸上写字显红色
参考答案:A.催化剂能同等程度增大反应速率,如加入催化剂,正逆反应速率都应增大,故A错误;
B.从图象可知,乙曲线斜率大,乙反应到达平衡用得时间少,则乙反应速率快,根据压强对反应速率的影响,压强越大反应速率越大,则乙曲线压强大,该反应是一个反应前后气体体积不变的化学反应,增大压强平衡不移动只是增大正逆反应速率,缩短到达平衡的时间,故B错误;
C.电镀时,镀层金属作阳极,应连接电源的正极,故C错误;
D.电解饱和食盐水,阳极生成氯气,阴极生成氢气和NaOH,滤纸中含有酚酞试液,则用外加保护膜的细铁棒做笔在滤纸上写字显红色,故D正确.
故选D.
本题解析:
本题难度:一般
3、选择题 pH值相同的盐酸溶液和醋酸溶液分别和锌反应,若最后锌都已完全溶解,放出的氢气一样多,则下列判断正确的是(?)
A.整个反应阶段平均速率:醋酸>盐酸
B.反应所需时间:醋酸>盐酸
C.参加反应的锌的质量:盐酸<醋酸
D.开始反应速率:盐酸>醋酸
参考答案:A
本题解析:pH值相同的盐酸溶液和醋酸溶液,醋酸的浓度远远大于盐酸,最后锌完全反应,说明醋酸和盐酸足量。A、因为醋酸的浓度大,反应时电离平衡向右移动,所以整个反应阶段平均速率:醋酸>盐酸,正确;B、醋酸平均反应速率大,则反应所需时间:醋酸<盐酸,错误;C、因为最后锌都已完全溶解,放出的氢气一样多,所以参加反应的锌质量相等,错误;D、开始时,pH相同,H+浓度相同,则开始时反应速率相等,错误。
本题难度:一般
4、选择题 向某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+B(g)?2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时问的变化如图所示:
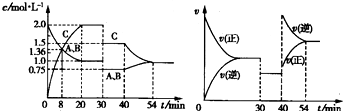
下列说法中正确的是( )
A.30~40?min时间段该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30?min时降低温度,40?min时升高温度
D.8?min前A的平均反应速率为0?08?mol?L-1?min-1?
参考答案:A.由图象可知,30~40?min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故B错误;
C.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,故C错误;
B.反应从开始到8min内A浓度减少了0.64mol/L,故A的反应速率为0.64mol/L8min=0.08 mol/(L?min),故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 在C(s)+CO2(g)  2CO(g)反应中可使反应速率增大的措施是
2CO(g)反应中可使反应速率增大的措施是
①缩小容器的体积;②增加碳的量;③通入CO2;④恒压下充入N2;⑤恒容下充入N2;⑥通入CO
A.①③⑥
B.②④⑥
C.①③⑤
D.③⑤⑥
参考答案:A
本题解析:①因为该反应有气体参加,所以缩小容器的体积,使气体物质的浓度增大,反应速率加快②碳单质是固体,固体的浓度不变,所以增加碳的量,化学反应速率不变。③通入CO2即增大了反应物的浓度,能使反应速率增大。④恒压下充入N2,使容器的体积扩大,反应生成物的浓度减小,反应速率减小。⑥通入CO,使气体生成物CO的浓度增大,反应速率加快。选项为;A。
本题难度:一般