1、选择题 可逆反应mA(s)+nB(g) eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数?(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是(?)
eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数?(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是(?)
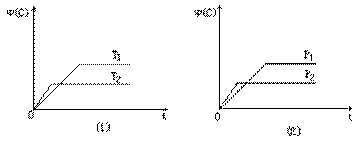
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
参考答案:B
本题解析:A、催化剂只改变化学反应速率,不改变化学平衡,因此C的体积分数不会变化,错误;B、从图⑴中可以看出,T2对应的线段先拐了,依据“先拐先平数值大”可以判断出T2>T1,且可以看出升高温度后C的体积分数减小,也就是说正向是一个放热的方向,因此,当平衡后,若温度升高,化学平衡向逆反应方向移动,正确;C、依据“先拐先平数值大”可以判断出P2>P1,且可以看出增大压强后C的体积分数减小,也就是说正向是体积增大的方向,即:n<e+f,错误;D、A是一种固体,量的改变不会影响化学反应速率和化学平衡,错误。
本题难度:一般
2、选择题 下列情况下,反应速率相同的是(? )
A.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
参考答案:A
本题解析:中和反应的实质是H++OH-=H2O,因为H+和OH-浓度相同,反应速率相同,A对;锌粉反应速率比锌粒反应速率快,B错;虽然HCl与CH3COOH浓度体积相同,但是CH3COOH存在电离平衡,H+浓度小,反应速率慢,C错;H2SO4与CaCO3反应,随着反应的进行,CaSO4微溶物覆盖在CaCO3表面,阻止了反应的进行,所以HCl反应速率快,D错
本题难度:一般
3、选择题 锌粒和稀盐酸反应一段时间后,反应速率减慢。此时,加热或加入浓盐酸,该反应速率明显加快。由此判断,影响化学反应速率的因素有
[? ]
①温度 ②固体的表面积 ③反应物的状态 ④溶液的浓度 ⑤催化剂
A.①③
B.②④
C.①④
D.①②③④⑤
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是(?)
①升高温度②加入正催化剂?③增大反应物浓度④将块状固体反应物磨成粉末⑤增大压强
A.①②③⑤
B.①②④⑤
C.①③④⑤
D.①②③④
参考答案:D
本题解析:略
本题难度:简单
5、选择题 已知C +CO2==2CO,其△H>0,反应速率为υ1,N2+3H2==2NH3,其△H<0,反应速率为υ2。对于上述反应,当温度升高时,υ1和υ2的变化情况为
[? ]
A. 同时增大
B. 同时减小
C. υ1增大, υ2减小
D. υ1减小, υ2增大
参考答案:A
本题解析:
本题难度:一般