1、选择题 下列有关说法正确的是(?)
A.原子的最外层有两个电子的元素都在第ⅡA族
B.元素周期律是元素原子核外电子排布周期性变化的结果
C.ⅠA族元素都是金属元素
D.多电子原子中,在离核较近的区域内运动的电子能量较高
参考答案:B
本题解析:A不正确,例如He在0族;C不正确,例如氢元素是非金属元素;多电子原子中,在离核较近的区域内运动的电子能量较低,D不正确,答案选C。
点评:该题是基础性试题的考查,考查的自身的比较分散,但都很基础,侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
2、选择题 X 、Y、 Z、 W是原子序数依次增大的四种短周期元素,A、B、C、D、F有其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol·L-1D溶液的pH为13(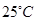 )。它们满足如图转化关系,则下列说法正确的是(?)
)。它们满足如图转化关系,则下列说法正确的是(?)
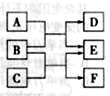
A.原子半径W>Z>Y>X
B.化合物F中含有共价键和离子键
C.在B和C的反应中,氧化剂是B,还原剂是C
D.Z元素的最高正价为+6
参考答案:B
本题解析:由题意可知D为一元强碱;根据B能与A、C反应生成同种物质且有一元强碱生成推断B是Na2O2,A是H2O,B是CO2,D是NaOH,E是O2,F是Na2CO3,则X、Y、 Z、 W分别是H、C、O、Na元素。A、根据元素周期律中原子半径的比较规律,原子半径W>Y>Z>X,错误;B、Na2CO3中含有共价键和离子键,正确;C、过氧化钠与二氧化碳的反应中,过氧化钠既是氧化剂又是还原剂,错误;D、O无最高正价,错误,答案选B。
本题难度:一般
3、填空题 (12分)A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置?;化合物M中含有的化学键类型有?
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示):?;写出C与A形成的18e-化合物的电子式?;
(3)用电子式表示A2C的形成过程:?
(4)写出题中生成M的化学方程式?
参考答案:(1)第三周期第ⅣA族;离子键、(极性)共价键;(2)H2O>NH3>SiH4;H2O2的电子式:
(3)H2O的形成过程: (4)NH3+HNO3=NH4NO3
(4)NH3+HNO3=NH4NO3
本题解析:根据题意可得:A是H,B是N;C是O;D是Na;E是Si。(1)Si元素核外电子排布是2、8、4,在周期表中的位置是位于第三周期第ⅣA族;化合物M是NH4NO3,是离子化合物。在阳离子和阴离子中都含有极性共价键,所以在该化合物中含有离子键和减小共价键。(2)元素的非金属性越强,其对应的氢化物的稳定性就越强,由于非金属性O>N>Si,所以O、N、Si形成的气态氢化物的稳定性由强到弱的顺序是H2O>NH3>SiH4;O与H形成的18e-化合物H2O2的电子式是 ;(3)H2O的形成过程电子式表示是:
;(3)H2O的形成过程电子式表示是: ;(4)生成M NH4NO3的化学方程式是NH3+HNO3=NH4NO3。
;(4)生成M NH4NO3的化学方程式是NH3+HNO3=NH4NO3。
本题难度:一般
4、选择题 2011年3月17日,因日本福岛第一核电站发生核辐射泄漏事故牵动了全世界。我国出现了抢购碘盐的事件,这是因为人们认为食用碘可以防止释放的放射性物质碘-131对人体的影响。已知核辐射中放射性碘(碘-131)的核电荷数为53。请根据你所学过的知识判断下列说法正确的是
A.碘-131是碘的同素异形体
B.碘127I原子和碘131I原子的质子数不同
C.核能的利用证实原子的可分性
D.加碘食盐中含有适量的碘单质,大量食用含碘食盐对人体有益
参考答案:C
本题解析:
正确答案:C
A.不正确,碘-131是碘的核素
B.不正确,碘127I原子和碘131I原子的中子数不同
C.正确,核能的利用证实原子的可分性,有些原子裂变时放出大量能量;
D.不正确,加碘食盐中含有适量的KIO3。
本题难度:一般
5、填空题
粒子符号
| 质子数(Z)
| 中子数(N)
| 质量数(A)
| 核外电子数
| 核电荷数
| 最外层电子数
|
K
| ?
| ?
| 39
| 19
| ?
| ?
|
?
| 8
| 10
| ?
| 10
| ?
| ?
|
Al3+
| ?
| 14
| ?
| ?
| 13
| ?
|
S2—
| ?
| ?
| 32
| ?
| 16
| ?
|
Ar
| ?
| 22
| ?
| ?
| ?
| ?
参考答案:
粒子符号
质子数(Z)
中子数(N)
质量数(A)
核外电子数
核电荷数
最外层电子数
K
19
20
39
19
19
1
O2—
8
10
18
10
8
8
Al3+
13
14
27
10
13
8
S2—
16
16
32
18
16
8
Ar
18
22
40
18
18
8
本题解析:根据质子数=核电荷数=核外电子数、质子数+中子数=质量数以及元素原子的核外电子排布可进行有关的计算和判断
点评:该题属于高考中常见的考点,属于基础性试题的考查,难度不大,需要学生熟练记住有关物理量之间的关系,并能灵活运用即可。
本题难度:简单
|