1、选择题 元素之间通过不同的化学键可以组成不同的晶体和化合物。有关化学键与晶体的说法正确的是
A.两种元素组成的分子中一定只有极性键
B.熔融状态时能导电的化合物一定是离子晶体
C.非金属元素组成的化合物一定是共价化合物
D.分子晶体的熔沸点随着共价键的增强而升高
参考答案:B
本题解析:A、可以含有非极性键,如双氧水,错误;B、共价化合物熔融不电离,正确;C、铵盐为离子化合物,错误;D、分子晶体的溶沸点与分子间作用力有关于化学键无关,错误。
本题难度:一般
2、选择题 科学家发现铂的两种化合物a和b:
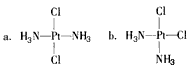
实验测得a和b具有不同的特性。a具有抗癌作用,而b没有,则下列关于a、b的叙述正确的是
[? ]
A.a和b属于同一种物质
B.a和b互为同分异构体
C.a和b的空间构型都是平面四边形
D.a和b的空间构型都是四面体
参考答案:BC
本题解析:
本题难度:一般
3、选择题 如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),
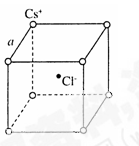
已知晶体中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的相对
分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
A.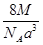 g· cm-3
g· cm-3
B.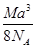 g· cm-3
g· cm-3
C.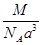 g· cm-3
g· cm-3
D. g· cm-3
g· cm-3
参考答案:C
本题解析:氯离子位于顶点,晶胞中数目为8×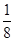 =1,铯离子位于体心,数目为1,即一个晶胞中含有一个氯离子和一个铯离子,则一个晶胞质量为
=1,铯离子位于体心,数目为1,即一个晶胞中含有一个氯离子和一个铯离子,则一个晶胞质量为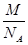 g,2个最近的Cl-离子核间距为acm,即晶胞边长为acm,则晶胞体积为:a3cm3,则密度为
g,2个最近的Cl-离子核间距为acm,即晶胞边长为acm,则晶胞体积为:a3cm3,则密度为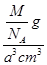 ?=
?=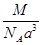 ?g· cm-3,故选C。
?g· cm-3,故选C。
本题难度:一般
4、选择题 已知磷酸分子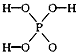 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸
(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出
H3PO2的分子结构是
[? ]
A.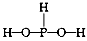
B.
C.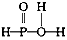
D.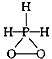
参考答案:B
本题解析:
本题难度:一般
5、简答题 已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素.D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图.请回答:
(1)A与B形成的化合物在固态时的晶体类型是______;A与B形成的化合物比A与C形成的化合物熔点要______(填高、低)
(2)写出C的单质与水反应的离子方程式______;
(3)如图所示,D跟B形成的离子化合物的化学式为______;鉴别该离子化合物是否为晶体,最可靠的科学方法是______,该离子化合物晶体的密度为ag?cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是______cm3(只要求列出算式).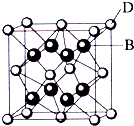
参考答案:已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大,E是周期表中1-18列中的第8列元素,所以E是Fe元素;D的原子序数比E小6,所以D是Ca元素;D跟B可形成离子化合物,该晶胞中含有B离子8个,D离子个数8×18+6×12=4,所以该化学式为D2B,B为第VIIA族元素,B和C属同一主族,且B的原子序数小于C,所以B是F元素,C是Cl元素,A与其他4种元素既不在同一周期又不在同一族,所以A是H元素.
(1)HF是共价化合物,形成的晶体是分子晶体,分子晶体的中物质的沸点随着相对分子质量的增大而增大,但分子间形成氢键的化合物使物质的沸点升高,氟化氢中含有氢键,氯化氢中不含氢键,所以氟化氢的沸点高于氯化氢,故答案为:分子晶体;高;
(2)氯气和水反应生成强电解质氯化氢和弱电解质次氯酸,所以其离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(3)Ca元素跟F元素可形成离子化合物,该晶胞中含有B两离子8个,D离子个数8×18+6×12=4,所以该化学式为CaF2,鉴别该离子化合物是否为晶体,最可靠的科学方法是X射线衍射法;
每个氟化钙晶胞中含有4个钙离子、8个氟离子,所以每个晶胞的质量为4MNA,密度是ag?cm-3,所以晶胞的体积=4(c+2b)NAacm3=8b+4caNAcm3,
故答案为:CaF2;X射线衍射法;8b+4caNA.
本题解析:
本题难度:一般