1、选择题 饱和氯水长期放置后,下列微粒在溶液中不减少的是( )
A.HClO
B.Cl2
C.Cl-
D.ClO-
参考答案:新制饱和氯水中存在Cl2+H2O?HClO+HCl,由于HClO见光分解,导致平衡右移,长期放置,Cl2和HClO、ClO-减少,HCl增多,则Cl-增大.
故选:C.
本题解析:
本题难度:一般
2、选择题 下列对氯气的性质及实验现象描述不正确的是
①钠在氯气中燃烧时产生白烟;②氢气在氯气中燃烧发出淡蓝色的火焰;③红热的铜丝在氯气中燃烧发出棕黄色的雾;④氯气跟水反应生成盐酸和次氯酸;⑤氯气有毒,液氯无毒
A.①②
B.②③⑤
C.②③④
D.①④
参考答案:B
本题解析:①钠在氯气中燃烧时产生白烟,正确;②氢气在氯气中燃烧发出苍白色的火焰,错误;③红热的铜丝在氯气中燃烧发出棕黄色的烟,而不是雾,错误;④氯气跟水反应生成盐酸和次氯酸,正确;⑤氯气有毒,液氯也有毒,错误。因此选B。
本题难度:一般
3、填空题 某课外活动小组欲制取次氯酸钠和氯化钠的混合溶液,为提高次氯酸钠的含量,用如图所示装置.图中瓶乙盛饱和食盐水,瓶丙盛放浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2与NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3)
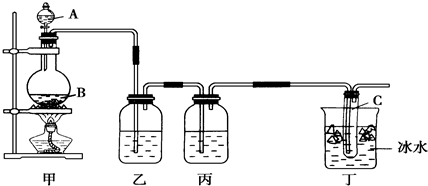
试回答:
(1)烧瓶B中盛______,试管C中盛______.
(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置______(填“能”或“不能”),理由是______.
②装置丙是否有必要______(填“有”或“没有”),理由是______.
(3)有同学认为还必须加入某些装置,你认为怎样?______(填“需要”或“不需要”),如果你认为需要,请指出该装置的作用______.
(4)丁装置中冰水的作用是______.
参考答案:(1)根据实验装置可知,首先制备氯气,发生反应为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O,则A中盛放浓盐酸,B中盛放MnO2,氯气和NaOH反应生成次氯酸钠,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,氯气经除杂后在C中和NaOH反应生成次氯酸钠,故答案为:MnO2;NaOH溶液;
(2)①乙装置不能省略,可用来除去HCl,否则会消耗NaOH,降低NaClO的含量,
故答案为:不能;HCl气体进入C中,消耗NaOH,降低NaClO的含量;
②氯气与氢氧化钠溶液反应生成次氯酸钠,反应在溶液中进行,则没有必要除去氯气中的水蒸气,
故答案为:没有;少量水蒸气进入C中,不影响反应;
(3)氯气有毒,不能直接排放到空气中,应有尾气处理装置,
故答案为:需要;应加上尾气处理装置,防止Cl2污染空气;
(4)要提高次氯酸钠的含量,根据题意可知应在较低温度下反应,否则如温度过高则易生成NaClO3,
故答案为:防止Cl2与NaOH溶液在温度较高时,发生其他反应.
本题解析:
本题难度:一般
4、选择题 下列关于卤素的描述正确的是()
A.若X表示卤素,则卤素单质与水反应的通式为:X2+H2O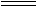 HXO+HX
HXO+HX
B.卤化氢都极易溶于水,其溶液都是强酸
C.卤化氢都可以用卤化物和浓H2SO4反应制取
D.卤素化合物中卤素的最高正价不都是+7价
参考答案:D
本题解析:卤素单质与水反应,F2为一特例,2F2+2H2O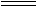 4HF+O2,所以A项不正确。卤化氢都能溶于水生成氢卤酸,只有HF为弱酸,其余为强酸,所以B项不正确。制取卤化氢,HF、HCl可用CaF2、NaCl与浓H2SO4共热制备,是利用H2SO4的高沸点来制备易挥发的HCl和HF,但HBr、HI不能用浓H2SO4来制备,因为浓H2SO4具有较强的氧化性,能氧化Br-与I-生成Br2和I2而得不到HBr和HI,所以制备HBr、HI只能用没有氧化性的高沸点的H3PO4,故C也不正确。卤素化合物氟的价态很特别,只有-1价而无正价。
4HF+O2,所以A项不正确。卤化氢都能溶于水生成氢卤酸,只有HF为弱酸,其余为强酸,所以B项不正确。制取卤化氢,HF、HCl可用CaF2、NaCl与浓H2SO4共热制备,是利用H2SO4的高沸点来制备易挥发的HCl和HF,但HBr、HI不能用浓H2SO4来制备,因为浓H2SO4具有较强的氧化性,能氧化Br-与I-生成Br2和I2而得不到HBr和HI,所以制备HBr、HI只能用没有氧化性的高沸点的H3PO4,故C也不正确。卤素化合物氟的价态很特别,只有-1价而无正价。
本题难度:简单
5、实验题 二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图。

(1)圆底烧瓶中发生反应的化学方程式为________。
(2)若要得到干燥纯净的气体,B、C中应分别盛放的试剂为________、________。
(3)E中若装有FeCl2溶液,反应的离子方程式为________,E中若装有淀粉碘化钾溶液,能观察到的实验现象是______________________________________。
(4)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象某化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是__________________________________________,
实验c的目的是_________________________________________________。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是____________________________________________。
参考答案:(1)MnO2+4HCl(浓)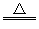 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)饱和食盐水?浓硫酸
(3)2Fe2++Cl2=2Fe3++2Cl-?溶液变蓝
(4)①探究c(Cl-)对反应的影响?探究c(H+)对反应的影响?②c(H+)的大小
本题解析:(1)MnO2与浓盐酸反应的化学方程式为:MnO2+4HCl(浓) MnCl2+
MnCl2+
Cl2↑+2H2O。
(2)用该方法制得的氯气中含有HCl和水蒸气,分别用饱和食盐水和浓硫酸除去。
(3)氯气与FeCl2溶液反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-。氯气将KI氧化为单质碘,单质碘使淀粉变蓝色。
(4)对比a、b、c、d、e五个实验方案可以看出,五个实验中都有MnO2和Cl-,只有a、c、e中有较大浓度的H+,这三个实验产生了Cl2,b、d中有较大浓度的Cl-,但无H+,没有产生Cl2,说明影响氯气生成的原因是H+浓度的大小。实验b的目的是探究c(Cl-)对反应的影响,实验c的目的是探究c(H+)对反应的影响。
本题难度:一般