1、实验题 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g) 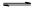 ?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH?0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式?。
(3)按下图装置进行如下实验:

步骤1:检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入足量的氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是?。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有?。
③以恒压滴液漏斗代替分液漏斗的目的是?。
④反应后期随着CO2气流减慢,导致反应物比例不当,可采取的相应措施是?。
(4)有同学认为该实验装置存在安全问题,请问可能面临的安全问题是?。
参考答案:(1)小于(2分)
(2)NH3+CO2+H2O=NH4HCO3(2分)
(3)①固体氢氧化钠或碱石灰(2分)
②不需要干燥;提供低温环境,提高转化率(2分 答对任意一点就给分)
③使氨水顺利滴下(2分)?④调节恒压滴液漏斗旋塞,减慢氨水滴加速度(2分)
(4)产品易堵塞导管,稀硫酸会倒吸(2分)
本题解析:(1)根据方程式2NH3(g)+CO2(g) 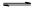 ?NH2COONH4(s)可知,该反应是熵值减小的可逆反应。如果该反应在一定条件下能够自发进行,则根据△G=△H-T·△S可知,该的焓变ΔH一定小于0。
?NH2COONH4(s)可知,该反应是熵值减小的可逆反应。如果该反应在一定条件下能够自发进行,则根据△G=△H-T·△S可知,该的焓变ΔH一定小于0。
(2)有水参加,则生成碳酸氢铵,因此反应的化学方程式为NH3+CO2+H2O=NH4HCO3。
(3)①由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥。因为氨气是碱性气体,所以干燥氨气应该用固体氢氧化钠或碱石灰。
②碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率。
③恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下。
④反应后期随着CO2气流减慢,导致反应物比例不当,此时可以通过调节恒压滴液漏斗旋塞,减慢氨水滴加速度加以控制。
(4)由于氨基甲酸铵是固体,所以产品易堵塞导管。又因为氨气极易溶于水,直接插入稀硫酸中吸收氨气,容易使稀硫酸倒吸。
本题难度:一般
2、选择题 除去乙烷中混有的乙烯,最好的方法是
[? ]
A.加入氢气与乙烯反应?
B.点燃
C.通入适量的溴水中?
D.通过KMnO4酸性溶液
参考答案:C
本题解析:
本题难度:一般
3、选择题 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质
[? ]
A.锌粉?
B.镁粉
C.铁粉?
D.铝粉
参考答案:C
本题解析:
本题难度:一般
4、选择题 为除去括号内的杂质,所选用的试剂或方法不正确的是(?)
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.FeCl2溶液(FeCl3),应加入过量Fe粉
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
参考答案:D
本题解析:A 正确,NaHCO3+NaOH=Na2CO3+H2O
B 正确,Fe+2FeCl3=3FeCl2
C 正确,2Na2O+O2=2Na2O2
D 错误,会引进新的杂质离子OH-。
本题难度:一般
5、实验题 (10分).选择适当的试剂和方法除去下列物质中所含的少量杂质(括号内为杂质):
物质
| 试剂
| 方法
|
(1)乙烷(乙烯)
| ?
| ?
|
(2)溴苯(溴)
| ?
| ?
|
(3)乙醇(水)
| ?
| ?
|
(4)乙酸乙酯(乙酸)
| ?
| ?
|
(5)苯甲酸(NaCl)
| ?
| ?
参考答案:(10分)
溴水或Br2的CCl4溶液
洗气
NaOH溶液
分液
CaO
蒸馏
饱和Na2CO3溶液
分液
水
重结晶
本题解析:乙烯能和溴水反应,但乙烷不能,所以可以用溴水除去乙烷中含有的乙烯;溴苯不溶于水,而单质溴能溶于氢氧化钠溶液,据此可以除去溴苯中的溴;乙醇和水时互溶的,所以要除去乙醇中的水,需要加入生石灰,然后蒸馏即可;乙酸乙酯在饱和碳酸钠溶液中的溶解度很小,而乙酸能溶于饱和碳酸钠溶液,所以可以用饱和碳酸钠溶液来除去乙酸乙酯中的乙酸;苯甲酸和氯化钠在水中的溶解度是不同的,据此可以通过重结晶进行分离。
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则:
1. 不能引入新的杂质(水除外)。即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中。
2. 分离提纯后的物质状态不变。
3. 实验过程和操作方法简单易行。即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:
1. 分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解) ,溶解,过滤(洗涤沉淀) ,蒸发,结晶(重结晶) ,电精炼。
2. 分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏。
3. 分离提纯物是胶体:盐析或渗析。
4. 分离提纯物是气体:洗气。
本题难度:一般
|