1、选择题 下列实验操作中错误的是
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发氯化钠溶液时,将溶液全部蒸干后,再停止加热
D.过滤时,玻璃棒的末端轻轻靠在三层滤纸处
参考答案:C
本题解析:A、分液漏斗中下层液体从下口放出,上层液体从上口倒出,可以彻底分开互不相溶的两种液体,正确;B、蒸馏时,测量蒸气的温度,所以温度计水银球靠近蒸馏烧瓶支管口,正确;C、蒸发溶液,当剩余少量水时停止加热,利用余热蒸发剩余的水,错误;D、三层滤纸处更坚固,所以过滤时,玻璃棒的末端轻轻靠在三层滤纸处,正确。
本题难度:一般
2、选择题 下列各组有机物中,只需加入溴水就能一一鉴别的是
A.己烯、苯、四氯化碳
B.苯、己炔、己烯
C.己烷、苯、环己烷
D.甲苯、己烷、己烯
参考答案:A
本题解析:A.己烯含有C=C键,可与溴水发生加成反应而使溴水褪色,苯和四氯化碳与溴水都不反应,但苯的密度不水小,色层在上层,四氯化碳的密度比水大,色层在下层,可鉴别,故A正确;
B.己炔、己烯都为不饱和烃,都能与溴水反应,不能鉴别,故B错误;
C.苯、环己烷都不与溴反应,且密度比水小,无法鉴别,故C错误;
D.甲苯、己烷都不与溴反应,且密度比水小,无法鉴别,故D错误。
故选A。
点评:本题考查有机物的鉴别,题目难度不大,注意把握常见有机物的性质,特别是水溶性和密度。
本题难度:一般
3、选择题 下列分离或提纯混合物的方法正确的是( )
A.在除去生石灰中的石灰石时,加水后进行过滤
B.用过滤的方法除去碘水中的碘
C.用乙醇萃取碘水中的碘
D.用溶解过滤蒸发的方法除去固体BaCl2中的BaSO4
参考答案:A.生石灰和水反应,除杂不能影响被提纯的物质,应用加热分解的方法分离,故A错误;
B.碘水能透过滤纸,应用萃取分离,故B错误;
C.乙醇和水互溶,应用四氯化碳作萃取剂,故C错误;
D.氯化钡可溶于水,硫酸钡不溶于水,溶于水后过滤即可分开,故D正确.
故选:D.
本题解析:
本题难度:一般
4、选择题 取5mL?0.1mol?L-1KI溶液,滴加0.1mol?L-1FeCl3溶液5~6滴,继续加入2mLCCl4,充分振荡,静置.下列有关该实验的说法不正确的是( )
A.下层CCl4溶液呈紫红色
B.取少量上层溶液,滴加酸性AgNO3溶液,若有黄色沉淀产生,则表明该反应存在化学反应限度
C.取少量上层溶液,滴加KSCN溶液,若溶液显红色,则表明该反应存在化学反应限度
D.该实验中KI与FeCl3反应后(未加CCl4),溶液中存在Fe3+、Fe2+、I-、I2等微粒
参考答案:B
本题解析:
本题难度:简单
5、填空题 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务.
(1)被称作海洋元素的是______(写元素符号).
(2)工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的化学方程式______,______.
(3)从海水中提取食盐和溴的过程如下:
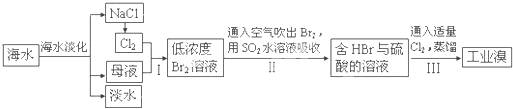
Ⅰ.①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素,请写出步骤Ⅱ的化学方程式:______.
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为图1中______.
Ⅱ.某化学研究性学习小组为?了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,设计了如装置简图2:

请你参与分析讨论:
①实验装置气密性良好,要在C中获得纯净的液溴即达到提纯溴的目的,操作中控制的关键条件是:______.
②为除去该产物中仍残留的少量Cl2,可向其中加入______溶液,充分反应后,再进行的分离操作是______.
参考答案:(1)地球上99%以上的溴都蕴藏在汪洋大海中,故溴有“海洋元素”的美称,故答案为:Br;
(2)工业上常以食盐为原料制备氯气,再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效,漂白粉的有效成分是次氯酸钙,空气中含有二氧化碳和水蒸气,会和次氯酸钙反应生成次氯酸,次氯酸见光分解生成氧气和氯化氢失去漂白性,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO?光照?.?2HCl+O2↑,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO?光照?.?2HCl+O2↑;
(3)Ⅰ、①步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,二氧化硫吸收溴单质发生反应,SO2+Br2+2H2O=H2SO4+2HBr,离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-,即步骤Ⅱ的化学方程式为SO2+Br2+2H2O═4H++2Br-+SO42-;
故答案为:SO2+Br2+2H2O═4H++2Br-+SO42-;
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,四氯化碳是难溶于水比水重的液体,溴单质在四氯化碳中的溶解度大于水中的溶解度,故答案为:D;
Ⅱ、①达到提纯溴的目的,操作中应控制的关键条件是把温度控制在溴的沸点59°C,并收集该温度下的馏分,故答案为:控制温度计b的温度,并收集59℃时的馏分;
②该产物中仍残留的少量Cl2,加入NaBr溶液发生反应:2NaBr+Cl2=2NaCl+Br2,可以除去氯气,生成的溴单质可以用萃取分液的方法得到,加热或蒸馏得到溴单质,故答案为:NaBr;萃取分液.
本题解析:
本题难度:一般