1、选择题 常温下最难与氢气发生反应的是( )
A.氮气
B.氯气
C.氟气
D.氧气
参考答案:氮气分子中含有N≡N,N≡N的键能非常大,不易断裂,所以氮气非常稳定不容易发生化学反应,因此氮气与氢气反应很难进行,需要高温高压催化剂的条件;
氯气比较活泼在光照或加热条件下能与氢气反应;
氟气非常活泼黑暗处就能与氢气反应;
氧气比较活泼在加热或点燃的条件下能与氢气反应;
所以最难与氢气发生反应的是氮气,故A正确;
故选A.
本题解析:
本题难度:简单
2、选择题 钯(Pd)元素的原子序数为46,下列叙述错误的是
[? ]
A.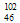 Pd和
Pd和 Pd互为同位素?
Pd互为同位素?
B.钯是第五周期元素
C.Pd2+核外有48个电子? ?
D.?Pd的原子核内有62个中子
参考答案:C
本题解析:
本题难度:简单
3、推断题 已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型氧化物分子中既有σ键又有π键。Z是金属元素,Z 的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单位为正方体(如下图),边长为
4.03×10-10m.顶点位置由Z4+所占,体心位置由Ba2+所占, 所有棱心位置为O2-所占。

(1)Y存周期表中位于________;Z4+的核外电子排布式为___________;
(2)X的该种氢化物分子构型为________,X在该氢化物中以________方式杂化。X和Y形成的化合物的熔点应该________(填“高于”或“低于”)X氧化物。
(3)①制备M的化学反应方程式是________________;
②在M品体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的________;
③在M晶体中,Z4+的氧配位数为______;
④已知O2-半径为1.40×10-10m,则Z4+的半径为_______m。
参考答案:(1)第四周期第ⅡA族;1s22s22p63s23p6
(2)直线形;sp;高于
(3)①TiO2+BaCO3=BaTiO3+CO2↑;②面心;③6;④6.15×10-11
本题解析:
本题难度:困难
4、选择题 HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是( )
A.CH4<H2O<HF<SiH4
B.SiH4<HF<CH4<H2O
C.SiH4<CH4<H2O<HF
D.H2O<CH4<HF<SiH4
参考答案:因同周期从左向右元素的非金属性增强,同主族元素从上到下元素的非金属性减弱,
C、Si同主族,C、O、F同周期,
则非金属性Si<C<O<F,
由非金属性越强,则对应的氢化物的稳定性越大,
则氢化物按稳定性由弱到强的顺序为SiH4<CH4<H2O<HF,
故选C.
本题解析:
本题难度:一般
5、选择题 下列化学用语,不能表示氯离子的是( )
A.Cl-
B.
Cl
C.
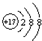
D.1s22s22p63s23p6
E.Cl
?
参考答案:A.根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,因此氯离子表示为:Cl-,故A正确;
B. ?3717Cl表示质子数为17,中子数为37的氯原子,故B错误;
C.
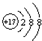
核内质子数为17,核外电子数为18,是氯离子,故C正确;
D.1s22s22p63s23p6核内质子数为17,核外电子数为18,是氯离子,故D正确.
E. ?3717Cl表示质子数为17,中子数为37的氯原子,故E错误;
故选BE.
本题解析:
本题难度:简单