|
高考化学知识点整理《化学反应进行的方向》高频考点强化练习(2019年最新版)(二)
2020-07-08 00:35:45
【 大 中 小】
|
1、选择题 符合下列条件的化学反应肯定是自发的是
A.△H<0,△S>0
B.△H<0,△S<0
C.△H>0,△S>0
D.△H>0,△S<0
|
参考答案:A
本题解析:根据△G=△H-T·△S可知,当△H<0,△S>0时反应一定是自发的,答案选A。
本题难度:一般
2、选择题 以下说法中正确的是(? )
A.△H<0的反应均是自发反应
B.自发进行的反应一定能迅速进行
C.冰在室温下自动熔化成水,是熵增的重要结果
D.高锰酸钾加热分解是一个熵减小的过程
参考答案:C
本题解析:A.△H<0的反应均是自发反应,不一定,如碳的燃烧,所以是放热反应,但是常温下还是不自发的,需要加热后才是自发反应。
B.自发进行的反应一定能迅速进行 ,不一定,反应自发与否和反应的快慢没有直接的联络。
C.冰在室温下自动熔化成水,是熵增的重要结果 ,正确。
D.高锰酸钾加热分解是一个熵减小的过程 ,是熵增大的过程;故选C 。
点评:对于反应的自发性判断依据是△G=△H-T△S △G——吉布斯自由能。
△H——焓变(△H<0为放热反应,△H>0为吸热反应)。
△S——熵(物质混乱度的量度,如固体变成气体,混乱度增加,△S>0)。
T——温度 判断反应能否自发进行用吉布斯自由能判据。
如果△G<0 反应可以自发进行;反之则不可以自发进行。
恒温恒压下:
当△H<0,△S>0时,反应自发进行;
当△H>0,△S<0时,反应不自发进行;
当△H>0,△S>0或△H<0,△S<0时,反应是否自发与温度有关,
一般低温时焓变影响为主;高温时,熵变影响为主,而温度影响的。
大小要看△H和△S的具体数值而定。
反应总是在一定条件下进行的。要讨论反应的自发性,也要指明反应条件。如果没有交代反应条件,只讲“某某反应不自发”“某某反应自发”,实际上是指在常温常压下进行的反应。“一定条件”指“一定的温度一定压强”。例如,反应 CaCO3=" CaO" + CO2↑ 在常温常压是非自发的,而在高温下则是自发发生的。 用吉布提自由能计算公式(△G=△H-T△S)来判断反应能否自发进行时,可以看到T对△G的值有影响,在某些情况下,可能决定△G是大于0还是小于0;式中△H 是一个与温度、压强有关的物理量。因此,讨论△G是大于0还是小于0,实际上也是在一定温度与压强下进行的。
本题难度:一般
3、选择题 影响某可逆反应限度的主要因素是
A.反应物的性质
B.反应的温度
C.反应物的浓度
D.反应体系的压强
参考答案:A
本题解析:影响某可逆反应限度的主要因素是反应物的性质,答案选A。
本题难度:简单
4、选择题 一定条件下在2 L的密闭容器中充入2 molSO2和2 molO 2,发生反应2SO2(g)+O2(g) 2SO3(g),进行到4 min时,测得n(SO2)="1.2" mol。下列说法正确的是 (? ) 2SO3(g),进行到4 min时,测得n(SO2)="1.2" mol。下列说法正确的是 (? )
A.反应进行到2 min时,容器中n(SO3)可能为0.5 mol
B.当v(SO2)∶v(O2)∶v(SO3)=2∶1∶2时该反应达平衡状态
C.温度升高时正反应速率增大,逆反应速率减小
D.4 min内氧气的平均反应速率为0.5 mol·L-1·min-1
参考答案:A
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以A不正确,B正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,B不正确;升高温度正逆反应速率都是增大的,C不正确;4 min内氧气的平均反应速率为 ,所以选项D不正确,答案选A。 ,所以选项D不正确,答案选A。
点评:该题是中等难度的试题,试题难易适中,贴近高考,有助于培养学生的逻辑思维能力,提高学生分析问题、解决问题的能力。
本题难度:简单
5、填空题 (15分,除标明外,其余每空2分)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO) 2(t-BuNO)
(1)当(t-BuNO)2的起始浓度(c0)为0.50mol·L-1时,实验测得20℃时的平衡转化率(α)是60%。20℃时上述反应的平衡常数K= 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”?“不变”或“减小”)。已知20℃时该反应在CCl4溶剂中的平衡常数为1.70mol·L-1,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”?“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH=+50.5kJ·mol-1,活化能Ea=90.4kJ·mol-1。下列能量关系图合理的是 (填字母)。

(4)该反应的ΔS (填“>”?“<”或“=”)0。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
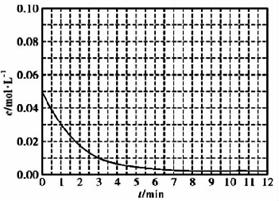
(5)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线
参考答案:(15分,除标明外,其余每空2分)
(1) 1.80mol·L-1 (2) 减小 小于
(3) D (4) > 较高
(5)如图(3分) 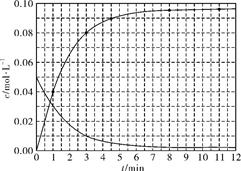
本题解析:(1)当(t-BuNO)2的起始浓度(c0)为0.50mol·L-1 20℃时的平衡转化率(α)是60%时,平衡时(t-BuNO)2的浓度为0.50mol/L×(1-60%)=0.2mol/L,t-BuNO的平衡浓度是0.50mol/L×60%×2=0.6mol/L,所以该温度下的平衡常数K=0.62mol/L/0.2mol/L=1.8mol/L;
(2)当增大(t-BuNO)2的起始浓度,因为反应物为1种,则相当于增大压强,平衡逆向移动,则(t-BuNO)2的转化率减小;已知20℃时该反应在CCl4溶剂中的平衡常数为1.70mol·L-1<1.8mol/L,说明在四氯化碳中,反应逆向进行,则它在CCl4溶剂中的平衡转化率小于其在正庚烷溶剂中的平衡转化率;
(3)实验测得该反应的ΔH=+50.5kJ·mol-1,活化能Ea=90.4kJ·mol-1,该反应是吸热反应,反应物的总能量低于生成物的总能量,排除B、C;活化能数值与反应热数值的比值小于2,A图不符合,所以答案选D;
(4)该反应中,物质的物质的量增加,混乱度增大,所以ΔS>0,因为ΔH>0,根据反应自发的判断依据ΔG=ΔH-TΔS<0反应自发,所以只有在较高温度时ΔG才可能小于0,反应自发;
(5)根据30℃时(t-BuNO)2浓度随时间变化的曲线,可计算出t-BuNO的浓度随时间的变化值,如:1min时(t-BuNO)2浓度减小0.05-0.03=0.02mol/L,则t-BuNO浓度从0增加到0.04mol/L,则(1,0.04)为一个点;3min时(t-BuNO)2浓度减小0.05-0.01=0.04mol/L,则t-BuNO浓度为0.08mol/L,(3,0.08)为1个点,依次做出不同时间的t-BuNO浓度的数值,用平滑曲线连起来即可,图像见答案。
考点:考查平衡常数的计算,化学反应与能量的关系图像的判断,反应自发依据的应用
本题难度:困难
|