1、计算题 (6分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入 3 mol A、7 mol B,起始时,甲、乙体积均为V? L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)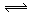 C(g)
C(g) +2D(g);ΔH<0
+2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V? L。
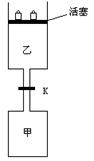
请回答:
(1)乙中B的转化率为?;
(2)甲中D和乙中C的物质的量比较:?(填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为?(用含V的代数式表示,连通管中气体体积忽略不计。)
参考答案:(1)20%?(2)后者大?(3)0.72V
本题解析:(1)? 3A(g)+2B(g)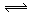 C(g)
C(g) +2D(g)
+2D(g)
起始量(mol)? 3? 7? 0? 0
转化量(mol)? 3x? 2x? x? 2x
平衡量(mol)? 3-3x? 7-2x? x? 2x
则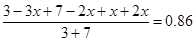
解得2x=1.4
所以B转化率是1.4÷7×100%=20%
(2)甲是保持等温等容的,而乙是保持等温等压的。又因为反应是体积减小的可逆反应,所以乙中反应物的转化率高于甲中反应物的转化率,因此乙中C的物质的量多。
(3)打开K,则相当于是等温等压下的可逆反应,因此和原来乙中平衡是等效的。此时消耗B是10.5mol×0.2=2.1mol,则消耗A是2.1mol÷2×3=3.15mol,生成C和D分别是1.05mol和2.1mol,如果设平衡时容器的总体积是X,则有
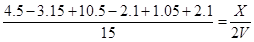
解得X=1.72VL
所以乙的体积为1.72VL-VL=0.72V。
本题难度:一般
2、填空题 (10分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) 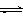 CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,ΔS=+133.7J?(K?mol) -1
①该反应能否自发进行与__________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是__________(填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
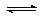 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所
需时间/min
|
H2O
| CO
| H2
| CO
|
1
| 650
| 2
| 4
| 1.6
| 2.4
| 5
|
2
| 900
| 1
| 2
| 0.4
| 1.6
| 3
|
3
| 900
| a
| b
| c
| d
| t
|
①实验1中以v(CO2) 表示的反应速率为__________。
②该反应的逆反应为 __________(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)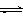 CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ?mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ?mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
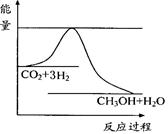
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
参考答案:(1)①温度(2分) ②bc(2分)
(2)① 0.16mol·L-1·min-1 (2分) ②吸(2分)
(3)cd(2分)
本题解析:略
本题难度:困难
3、填空题 灰锡(结构松散,常粉末状存在)和白锡(坚固耐用),是锡两种同素异形体.
已知:Sn(s,灰) Sn(s,白) ΔH=+2.1 kJ/mol,△S=6.5J·mol-1.;求出灰锡器皿不损坏的温度是?℃((填“ >”、“ < ”或“=”)
Sn(s,白) ΔH=+2.1 kJ/mol,△S=6.5J·mol-1.;求出灰锡器皿不损坏的温度是?℃((填“ >”、“ < ”或“=”)
参考答案:大于50℃
本题解析:根据△G=△H-T·△S可知,如果ΔH=+2.1 kJ/mol,△S=6.5J·mol-1.,则要使逆反应不能自发进行,则△G=△H-T·△S>0,解得T>323K,即大于50℃。
本题难度:一般
4、选择题 已知“凡气体分子总数增多的反应一定是熵增大的反应”。一定条件下,下列反应不可能自发进行的是
[? ]
A. 2O3 (g)==3O2 (g) △H<0
B. 2CO(g)==2C(s)+O2 (g) △H>0
C. N2(g)+3H2 (g)==2NH3 (g) △H<0
D. CaCO3 (s)==CaO(s)+CO2 (g) △H>0
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列说法正确的是:
A.已知某温度下纯水中的C(H+)=2×l0-7mol/L,据此无法求出水中C(OH-)
B.常温,Mg(OH)2能溶于氯化铵浓溶液主要原因是NH4+结合OH-使沉淀溶解平衡发生移动
C.已知:
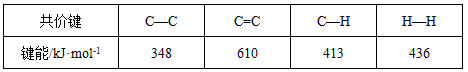
上表数据可以计算出 (g)+3H2(g)→
(g)+3H2(g)→ (g)的焓变
(g)的焓变
D.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2/L2
参考答案:B
本题解析:A不正确,任何纯水中氢离子浓度等于OH-浓度;由于苯环中的化学键是一种介于碳碳单键和碳碳双键之间的一种独特的化学键,所以不能计算出该反应的反应热;D不正确,因为两种溶液中c(CO32-)浓度不同,所以镁离子的浓度也是不同的,所以答案选B。
点评:溶解平衡也是一种动态平衡,在判断外界条件对平衡状态的影响时,也需要借助于勒夏特例原理。另外溶度积常数也和化学平衡常数相似,在计算时可以进行类推即可。
本题难度:一般