1、选择题 下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
A.
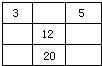
B.
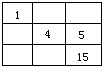
C.
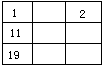
D.

参考答案:A、3号和5号元素之间相差很多个族,即12号的镁和13号的铝在周期表中不相邻,故A错误;
B、5号和15号元素的原子不在同一主族,故B错误;
C、1号和11好中间还有3号元素,故C错误.
D、O、Cl、Ne的位置关系是正确的,故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 下列关于元素周期表和元素周期律的说法错误的是( )
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
参考答案:A、Li、Na、K属同一主族,核外电子层数随着核电荷数增加而增多,故A正确;
B、根据元素周期律:同周期元素的原子从左到右,元素非金属性逐渐增强可推知第二周期元素从Li到F非金属性逐渐增强,故B正确;
C、Na与K比较,K更易失电子,还原性更强,故C错误;
D、同主族元素的原子从上到下,元素非金属性逐渐减弱,O与S同主族,O的非金属性强,故D正确.
故选C.
本题解析:
本题难度:简单
3、推断题 化合物YX3、ZX2中,X、Y、Z的核电荷数均小于18;X原子的最外能层的p能级中有一个轨道填充了2个电子,Y原子的最外能层中p能级的电子数等于前一能层的电子总数,且X和Y具有相同的电子层数;Z与X在元素周期表中位于同一主族。回答下列问题:
(1)X元素基态原子的电子排布式为__________,Y元素的价电子排布图为_________。
(2)ZX2的分子式是______,YX2的电子式是_________。
(3)Y与Z形成的常见化合物的分子式是______,该化合物分子的空间构型是___________。
参考答案:(1)1s22s22p4;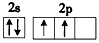
(2)SO2;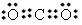 (3)CS2;直线形
(3)CS2;直线形
本题解析:
本题难度:一般
4、选择题 不能说明钠的金属性比镁强的事实是
A.钠的最高化合价为+1,镁的最高化合价为+2
B.NaOH的碱性比Mg(OH)2强
C.钠与冷水反应剧烈,镁与冷水不易反应
D.在熔化状态下,钠可以从MgCl2中置换出镁
参考答案:A
本题解析:金属性是指元素原子的失电子能力,与失电子多少无关,与化合价无关,B、C、D选项均可判断金属性强弱.
本题难度:困难
5、选择题 下列关于元素周期表和元素周期律的说法不正确的是( )
A.从氟到碘,生成的氢化物熔、沸点逐渐升高,稳定性逐渐减弱
B.因为钠原子比铝原子容易失去电子,所以钠比铝的还原性强
C.从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强
D.氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的氧化性强
参考答案:A.HF中含有氢键,熔沸点最高,从氟到碘,非金属性逐渐减弱,则氢化物的稳定性逐渐减弱,故A错误;
B.同周期元素从左到右金属性逐渐减弱,则钠原子比铝原子容易失去电子,钠比铝的还原性强,故B正确;
C.元素的金属性越强,对应最高价氧化物的水化物碱性越强,元素的非金属性越强,最高价氧化物的水化物酸性越强,所以从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强,故C正确;
D.硫位于氧元素的下一周期,原子半径较大,同一主族元素从上到下元素的非金属性逐渐减弱,对应单质的氧化性逐渐减弱,故D正确.
故选A.
本题解析:
本题难度:简单