1、推断题 有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元素原子最外层电子数占核外总电子数的3/4;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族。
(1)写出元素符号:X__________,Y___________,Z__________,W___________。
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是_____________________________。
(3)把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是____________,反应的化学方程式是
_____________________________。
参考答案:(1)H;O;Mg;Cl
(2)Mg(OH)2+2HClO4==Mg(ClO4)2+2H2O
(3)有气泡、变红;Mg+2H2O Mg(OH)2+H2↑
Mg(OH)2+H2↑
本题解析:
本题难度:一般
2、选择题 下列递变情况中,正确的是
A.Na、Mg、Al原子的最外层电子数依次减少?
B.Si、P、S元素的最高正价依次降低
C.C、N、O的原子半径依次减小?
D.Li、Na、K的金属性依次减弱
参考答案:C
本题解析:同周期元素,原子序数越大,非金属性越强;同主族元素,原子序数越大,金属性越强。
本题难度:一般
3、选择题 稀土元素是指镧系元素及第五周期第ⅢB族的钇(39Y),它们享有“工业味精”、“新材料之母”的美誉。下列有关稀土元素的说法中正确的是
[? ]
A.它们的原子核外均有5个电子层
B.它们的原子最外电子层均有3个电子
C.它们均是金属元素
D.76Y、80Y中子数不同,化学性质不同
参考答案:C
本题解析:
本题难度:简单
4、推断题 前四周期元素X、Y、Z、W核电荷数依次增加,并且X、Y、Z的核电荷数之和为32;Y原子基态时被电子占据的轨道有9个,其中6个被电子占满;非金属元素Z的?M层上成对电子与未成对电子所占据的原子轨道数相等;W3+离子的3d轨道中有10个电子。
(1)W基态原子的电子排布式为_____________。
(2)Y可与X形成只含一个中心原子的共价化合物a,其电子式是__________;中心原子的价层电子对数为_______;a分子的立体构型是____________。
(3)Z的低价氧化物既氧化性又有还原性,请分别举例说明______、_______(写化学方程式)。
(4)Y4分子的键角是_________?。我们还学过了很多与Y4空间构型相同但键角不同的分子,请列举一种分子_________(写电子式)?。
参考答案:(1)?1s22s22p63s23p63d104s24p1?(或[Ar]3d104s24p1?)? ?
(2)?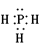 ;4?;三角锥型
;4?;三角锥型
(3)2H2S+SO2=3S+2H2O?;?SO2与O2、卤水等均可
(4)60;?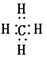
本题解析:
本题难度:一般
5、选择题 有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
[? ]
A.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
B.若X(OH)n为强碱,则Y(OH)n也一定为强碱
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
参考答案:B
本题解析:
本题难度:一般