1、填空题 (5分)在25℃时,用石墨电极电解2.0 L,2.5 mol/L CuSO4溶液,如有0.2 mol电子发生转移,试回答下列问题:
⑴电解后得到的Cu的质量是??,得到O2的体积(标准状况)是??,溶液的pH是??。
⑵如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差??,电解液的pH??(填“变小”、“变大”或“不变”)
参考答案:(共5分,每空1分)
⑴6.4g? 1.12L? pH="1?" ⑵12.8g?不变
本题解析:略
本题难度:一般
2、填空题 (每空2分,共14分)电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
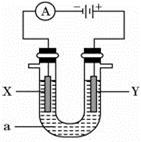
(1)若X、Y都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①Y电极上的电极反应式为____________________,该电极产生的现象是 。
②该反应的总反应化学方程式是: ______________________________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是__________,电极反应式是____________________。
(3)若用惰性电极电解500 mL CuSO4溶液,溶液中 Cu2+ 完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极质量增加1.6 g。
①要使电解后溶液恢复到电解前的状态,需加入一定量的________(填加入物质的化学式)。(假设电解前后溶液的体积不变)
②溶液的pH= 。
参考答案:(1)①2Cl——2e-=Cl2 ↑ 产生淡黄绿色气泡 ②2KCl+2H2O 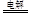 2KOH+Cl2 ↑+H2↑
2KOH+Cl2 ↑+H2↑
(2)纯铜(或精铜) Cu2++2e-=Cu (3)①CuO或CuCO3 ② 1
本题解析:(1)①和电源的正极相连的电极Y极是阳极,该电极上Cl-离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,现象为产生淡黄绿色气泡②阳极上是Cl-离子失电子,阴极上是H+离子得电子,电解总反应离子方程式为:2KCl+2H2O 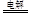 2KOH+Cl2 ↑+H2↑;
2KOH+Cl2 ↑+H2↑;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜;电极反应为Cu2++2e-=Cu;
(3)惰性电极电极硫酸铜溶液,从溶液中析出的物质有铜和氧气,所以需加入一定量CuO或CuCO3,
②该反应总的电解方程式为2CuSO4 +2H2O 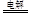 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
128 2
1.6 x 解得x=0.025mol
[H+]=0.05/0.5=0.1mol/L,则溶液的PH=1.
考点:考查电解原理的应用。
本题难度:一般
3、填空题 工业上用电解饱和食盐水的方法生产氯气和烧碱.
(1)食盐溶于水发生电离,其电离方程式为______
(2)电解食盐水的原理是:
______NaCl+______H2O
______H2↑+______Cl2↑+______NaOH
(将上述化学方程式中各物质的化学计量数填在横线上)
(3)2004年4月15日,某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为______(用离子方程式表示).
(4)事件过后,附近居民向记者反映当时晾在外面的衣服褪色了,其原因是______(结合化学方程式解释).
参考答案:(1)氯化钠是强电解质,在水分子作用下完全电离出阴阳离子,所以其电离方程式为:NaCl=Na++Cl-,
故答案为:NaCl=Na++Cl-;
(2)电解饱和食盐水生产烧碱(NaOH),同时生成氯气(Cl2)和氢气,从生成物氢气和氯气开始配平,生成1分子氢气需要得到2个电子,生成1分子氯气需要失去2个电子,得失电子相等,然后观察法配平,该反应的化学方程式为:2NaCl+2H2O电解.2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O电解.2NaOH+Cl2↑+H2↑;
(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气和水反应生成次氯酸,反应方程式为:Cl2+H2O=HCl+HClO,HClO具有强氧化性,可漂白,所以能使湿衣服褪色,
故答案为:Cl2+H2O=HCl+HClO,HClO具有强氧化性,可漂白有色物质.
本题解析:
本题难度:一般
4、选择题 用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )
A.稀NaOH溶液
B.HCl溶液
C.NaCl溶液
D.酸性AgNO3溶液