1、选择题 有10.2g镁和铝的混和粉末溶于500mL?4mol?L-1的盐酸中.若加入2mol?L-1的氢氧化钠溶液,要使产生的沉淀的质量最大,则需加入的氢氧化钠溶液的体积为
A.100ml
B.500mL
C.1000mL
D.1500mL
参考答案:C
本题解析:分析:由题意可知,酸碱恰好完全中和时产生的沉淀的质量最大,利用盐酸与氢氧化钠的反应的关系来计算.
解答:因产生的沉淀的质量最大,钠元素和氯元素以NaCl存在,
即相当于酸碱恰好中和时沉淀量最大,
设需加入的氢氧化钠溶液的体积为为x,
则? ?HCl~NaOH
? ?1? 1
0.5L×4mol/L? x×2mol/L
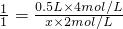 ,
,
解得x=1L=1000mL,
故选C.
点评:本题考查金属与酸及盐与碱反应,明确生成沉淀最大时钠与氯元素的存在形式是解答本题的关键,然后利用关系式法即可计算解答.
本题难度:一般
2、选择题 下列离子方程式不正确的是
A.石英与烧碱溶液反应:SiO2+2OH-===SiO32—+H2O
B.向氢氧化钠溶液中通入过量CO2:CO2+2OH-===CO32—+H2O
C.向硅酸钠溶液中加入盐酸:2H++SiO32—===H2SiO3↓
D.向碳酸钙上滴稀硝酸:CO32—+2H+===H2O+CO2↑
参考答案:BD
本题解析:B项中通入过量CO2应产生HCO;D项CaCO3是难溶物质,故不能写成CO,应为CaCO3+2H+===H2O+Ca2++CO2↑。
本题难度:困难
3、选择题 室温下,下列各组物质相混合不能产生可燃性气体的是
A.铜与浓硝酸
B.铝与氢氧化钠溶液
C.钠投入硫酸铜溶液中
D.铁与稀硫酸
参考答案:A
本题解析:分析:A、铜和浓硝酸反应生成二氧化氮气体、一氧化氮气体不是可燃性气体;
B、铝和氢氧化钠反应生成偏铝酸钠和氢气,氢气是可燃气体;
C、钠投入硫酸铜溶液中,钠和水反应生成氢氧化钠和氢气,氢气是可燃性气体;
D、铁和稀硫酸反应生成硫酸亚铁和氢气,氢气是可燃性气体;
解答:A、铜和浓硝酸反应生成二氧化氮气体、随溶液浓度变稀,生成气体为一氧化氮气体,二氧化氮和一氧化氮都不是可燃性气体;故A符合;
B、铝是两性元素和强碱强酸反应,和氢氧化钠反应生成偏铝酸钠和氢气,氢气是可燃气体;故B不符合;
C、钠投入硫酸铜溶液中,钠和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,其中氢气是可燃性气体;故C不符合;
D、铁和稀硫酸反应生成硫酸亚铁和氢气,氢气是可燃性气体;故D不符合;
故选A.
点评:本题考查了铜、铝、钠、铁金属的性质分析判断,可燃性气体的判断应用,题目较简单.
本题难度:一般
4、选择题 将足量的铜与一定体积?10mol?L-1的浓硝酸充分反应,得到Cu(NO3)2溶液和NO2、NO混合气体,将集满混合气体的容器倒扣在水中,通入2.24L?O2(标准状况)后,所有气体完全被水吸收生成硝酸.发生反应为:4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3.若向所得Cu(NO3)2溶液中加入5mol?L-1NaOH溶液使Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.40?mL
B.60?mL
C.80?mL
D.100?mL
参考答案:C
本题解析:分析:整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了,根据电子得失守恒,求出参加反应的铜,然后求出 Cu(NO3)2,再根据 Cu(NO3)2与NaOH 反应的关系,求出NaOH的物质的量,进而计算NaOH溶液的体积.
解答:完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了,
根据得失电子守恒:n(Cu)×2=n(O2)×4,即n(Cu)×2=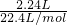 mol×4,
mol×4,
解得n(Cu)=0.2mol,所以Cu(NO3)2 =0.2mol,则:
?Cu2+~2OH-
? ?1? ?2
?0.2mol? n(OH-)
所以n(OH-)=0.2mol×2=0.4mol
需要NaOH溶液的体积为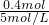 =0.08L=80mL,
=0.08L=80mL,
故选C.
点评:本题考查混合物计算、氧化还原反应计算等,难度较大,利用常规方无法解答,是守恒思想在混合计算典型利用,判断金属失去的电子等于氧气获得的电子是关键.
本题难度:简单
5、选择题 下列元素在自然界没有游离态存在的是
A.碳
B.硅
C.氮
D.硫
参考答案:B
本题解析:碳,氮,硫在自然界都有化合态和游离态存在,只有硅主要以化合物的形式存在。
本题难度:一般