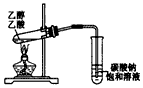
1、实验题 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的装置和实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,又有晶体析出,……

请回答下列问题:
(1)装置的连接顺序是:(a)接(_____)→(_____)接(____);(b)接(____)
(2)A中常选用的固体反应物为_________;D中应选用的液体为_____________;
(3)B装置中分液漏斗内所加试剂为_________;第二步中必须先让________装置先发生反应。C中用球形干燥管而不用直导管,其作用是__________;
(4)第四步分离所得的晶体中含有多种成分,试证明其中含有NH4Cl,简要写出操作过程和现象________________________。
2、选择题 下列实验方案合理的是
[? ]
A.配制50g质量分数为5%的NaCl溶液:将45mL水加入到盛有5g NaCl的烧杯中,搅拌溶解
B.制备乙酸乙酯用上图所示的实验装
C.鉴定SO42-:向溶液中加入盐酸酸化的氯化钡溶液
D.鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中
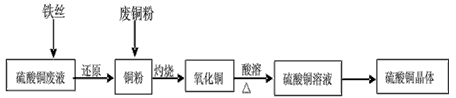
3、实验题 利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有___________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是_____,该还原反应的化学方程式是_____________________。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)______________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是____________。
4、实验题 已知使用林德拉催化剂(Pd/PbO、CaCO3,其中钯附于碳酸钙及少量氧化铅上)可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示的仪器组装而成的实验装置(铁架台未画出),由乙炔制得乙烯,并测定在氢化反应中乙炔的转化率。若用含0.020 mol CaC2的电石和含1.30g锌的锌粒(杂质不与酸反应)分别与足量的饱和食盐水和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水的体积为V mL(忽略乙炔在水中溶解的部分)。试回答下列问题:
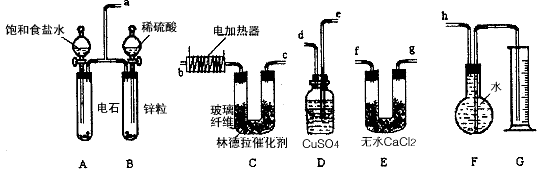
(1)各装置的连接顺序为a→_____ →_____→_____→ _____→_____ → _____→h。
(2)写出C中所发生的两个反应的化学方程式:__________ 。
(3)装置A中产生气体的反应速率往往太快,为了减慢反应速率,操作时还应采取的措施是________。
(4)装置D的作用______________ 。
(5)G所选用的量筒的容积较合理的是_________ (填写选项字母)。
A. 500mL
B. 1000mL
C. 2000mL
(6)若V=672(导管内气体体积忽略不计),则乙炔的转化率为___________。
5、实验题 某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
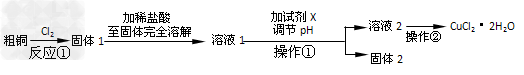
(1)实验室采用如下图所示的装置,可将反应①粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
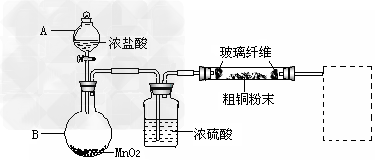
①?仪器A的名称是_________________。
②?连接好装置后,加入药品前,应该进行的实验操作是_______________。
③?装置B中发生反应的离子方程式是______________。
④?有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)________________。 ?
⑤?虚线内缺少实验装置,请你画出装置图,标明药品名称。
(2)试剂X用于调节pH以除去杂质,?X可选用下列试剂中的(填序号)___________。
a.NaOH?b.NH3·H2O?c.CuO?d.Cu2(OH)2CO3?e.CuSO4
操作①的名称是______________。
(3)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+ (aq)?+4Cl-(aq)?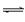 CuCl42-(aq)?+4H2O(l)
CuCl42-(aq)?+4H2O(l)
? 蓝色?黄色
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)_____________。
a.将Y稀释,发现溶液呈蓝色 b.在Y中加入CuCl2晶体,溶液变为绿色 c.在Y中加入NaCl固体,溶液变为绿色 d.取Y进行电解,溶液颜色最终消失 ?
(4)操作②需在氯化氢气流中经过加热浓缩、__________、过滤、洗涤、干燥。