1、简答题 某化学兴趣小组以碳和浓硝酸为起始原料,想利用一氯化氮与过氧化钠反应制备亚硝酸钠.设计装置如下:(忽略装置中空气的影响)
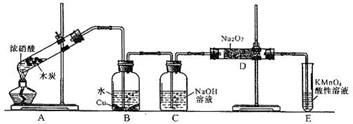
请回答下列问题:
(1)装置A的试管中发生反应的化学方程式是______.
(2)猜测B中可以观察的主要现象是______.C瓶出来的气体是______.
(3)已知:①室温下存在反应3HNO2=HNO3+2NO↑+H2;②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成.写出检验D中产物是亚硝酸钠的方法:______.
(4)E装置的作用是______.
(5)同学们经过讨论认为上述装置仍有缺陷,为避免D管中生成NaOH,你认为应该进行的改进是______.
参考答案:(1)A装置为C与HNO3(浓)反应制取NO2,反应方程式为C+4HNO3(浓)?△?.?CO2↑+4NO2↑+2H2O.
故答案为:C+4HNO3(浓)?△?.?CO2↑+4NO2↑+2H2O
(2)A中产生的NO2,进入B中与水反应生成硝酸,硝酸再与铜反应,方程式为 3Cu+8HNO3(稀)=3Cu(HO3)2+2NO↑+
4H2O,所以,溶液逐渐变蓝.即使有未反应完全的NO2,被C中NaOH吸收,从C中出来的气体为NO.
故答案为:溶液逐渐变蓝;NO
(3)根据题目给的信息可知:①常温下HNO2不稳定;②在酸性溶液中,NO2-可将MnO4-还原为Mn2+,使溶液紫色褪去,据此设计方案.
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.反应的离子方程式是3NO2-+2H+=NO3-+2NO↑+H2O
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠,反应的离方程式是5?NO2-+2MnO4-+6H+=5?NO3-+2Mn2++3H2o
故答案为:
方法I:将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠.
方法II:将生成物置于试管中,加入酸性KMnO4溶液,若溶液紫色褪去,则D中产物是亚硝酸钠;
(4)D中可能有未反应完全的NO,NO有毒气体,不能直接排放到空气中,通过E装置吸收,以免污染空气.
故答案为:吸收D中未反应完的NO,以免污染空气
(5)过氧化钠与水反应生成NaOH,进入D管气体应干燥,故应在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
故答案为:在C、D之间增加一个盛浓硫酸的洗气瓶(或装无水CaCl2的干燥管)
本题解析:
本题难度:一般
2、选择题 北京时间2011年9月29日21时16分,我国在酒泉卫星发射中心载人航天发射场,用“长征二号F”T1运载火箭成功发射全新研制的首个目标飞行器“天宫一号”。从下图的发射现场可以看到:从火箭的下部喷射出红棕色的气体,关于这种红棕色气体的认识正确的是

[? ]
A.红棕色气体是溴蒸气,可以喷洒NaOH溶液吸收
B.红棕色气体是NO2,可以喷洒稀碱溶液吸收
C.红棕色气体是N2O4,可以喷洒稀碱溶液吸收
D.红棕色气体是NO,可以喷洒NaOH溶液吸收
参考答案:B
本题解析:
本题难度:简单
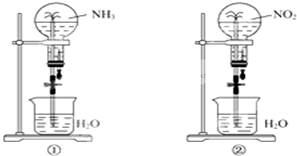
3、选择题 如图所示,集气瓶内充满某混合气体,将滴管内的水挤入集气瓶后,烧杯中的水会进入并充满集气瓶,集气瓶内气体可能是( )
A.O2、NO2
B.H2、O2
C.N2、H2
D.NO2、NO