1、简答题 (12分)硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g) 2SO3(g)达到平衡状态。
2SO3(g)达到平衡状态。
①上述反应平衡常数的表达式K=__________
②能判断该反应达到平衡状态的标志是__________。(填字母)
a. SO2和SO3浓度相等? b. SO2百分含量保持不变
c. 容器中气体的压强不变? d. SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率(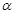 )与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
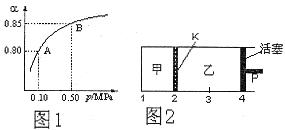
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲__________乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__________填:“增大”、“减小”、“不变”、“无法确定”)
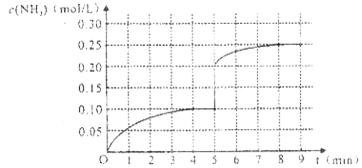
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。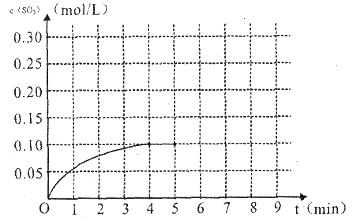
参考答案:(1)①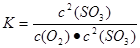 ?②bc
?②bc
(2)=?(3)①小于?②不变?(4)
本题解析:(1)①平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该反应的表达式为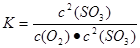 。
。
②在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以b正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,a不正确。反应时体积减小的,因此在反应反应过程中,压强是变化的,c正确。D中反应速率的方向是相同的,是恒成立的,d不正确,答案选bc。
(2)平衡常数只与温度有关系,所以AB两点的平衡常数相等。
(3)①乙的容积和甲相等时,相当于增大乙中压强,所以平衡向正反应方向移动,因此乙中SO2的体积分数大于甲中的。
②由于甲的体积不变,所以其浓度不变,平衡不移动,因此c(SO3)/c(SO2)不变。
在第5分钟将容器的体积缩小一半,则瞬间物质的浓度都是原来的2倍,但平衡向正反应方向移动,所以变化曲线是(见答案)。
本题难度:一般
2、填空题 Ⅰ、一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)?ΔH>0。
FeO(s)+CO(g)?ΔH>0。
(1)下列措施中能使平衡时c(CO)/c(CO2)增大的是?(填序号)。
A.升高温度?B.增大压强
C.充入一定量氮气? D.再加入一些铁粉
(2)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,使CO2的浓度成为原来的2倍,则CO2的转化率将?(填“增大”、“减小”或“不变”)。
Ⅱ、在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)  CO(g)+H2(g),试分析和回答下列问题:
CO(g)+H2(g),试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是?(选填序号)。
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其他条件不变),则容器内气体的平均相对分子质量将?(填写“不变”、“变小”或“变大”)。
参考答案:Ⅰ、(1)A? (2)不变?Ⅱ、(1)B、D? (2)变大
本题解析:解答该题要注意以下三点:
(1)根据CO与CO2的浓度比值关系得出平衡移动的方向,然后再进行判断。
(2)增大反应物的浓度,反应物的转化率不一定减小;转化率等于转化浓度比起始浓度。
(3)气体的平均相对分子质量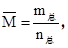 其变化与m总、n总均有关。
其变化与m总、n总均有关。
Ⅰ、(1)使平衡时c(CO)/c(CO2)增大,则需要使平衡向正反应方向移动,CO2的浓度减小,CO的浓度增大, 比值增大。反应为吸热反应,升高温度平衡向正反应方向进行,A对;反应前后气体的物质的量不变,增大压强平衡不移动,B错;充入N2对平衡没有影响,C错;铁粉的量的多少对平衡没有影响,D错。
(2)增大CO2的浓度,反应物中只有CO2为气体,且反应前后气体体积相等。相当于增大压强,平衡不发生移动,CO2的转化率不变。
Ⅱ、(1)因为在恒压容器中进行,压强一直不变,A错;当v正(CO)=v逆(H2O)时,反应达到平衡,B对;任何时刻生成的CO与H2物质的量都相等,C错;1 mol H—H键断裂说明有1 mol H2反应,断裂2 mol H—O键说明有1 mol H2O反应,反应达到平衡,D对。
(2)原平衡状态中CO、H2的平均相对分子质量为 加压时平衡逆向移动,H2O(g)(相对分子质量为18)的含量增大,混合气体的平均相对分子质量增大。
加压时平衡逆向移动,H2O(g)(相对分子质量为18)的含量增大,混合气体的平均相对分子质量增大。
本题难度:一般
3、选择题 已知反应①:CO(g)+CuO(s)?CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=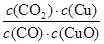
B.反应③的平衡常数K=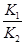
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
参考答案:B
本题解析:在书写平衡常数表达式时,纯固体不能表示在平衡常数表达式中,A错误。由于反应③=反应①-反应②,因此平衡常数K=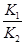 ,B正确。反应③中,温度升高,H2浓度减小,则平衡向左移动,即逆反应为吸热反应,正反应为放热反应,应为ΔH<0,C错误。对于反应③,在恒温恒容下,增大压强,如充入稀有气体,则平衡不移动,H2的浓度不变,D错误。
,B正确。反应③中,温度升高,H2浓度减小,则平衡向左移动,即逆反应为吸热反应,正反应为放热反应,应为ΔH<0,C错误。对于反应③,在恒温恒容下,增大压强,如充入稀有气体,则平衡不移动,H2的浓度不变,D错误。
本题难度:一般
4、选择题 在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2H1(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅
B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大
C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=25mol/L
D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60%
参考答案:C
本题解析:略
本题难度:简单
5、填空题 (14分)FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行(?)次实验。
A.1
B.2
C.3
D.4