1、填空题 (15分)填写下列空白:
(1)Fe(OH)3胶体呈红褐色,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,这种现象叫______________。
(2)强光通过Fe(OH)3胶体,可看到光带,这种现象叫________________。
(3)淀粉与食盐的混合液放在肠衣(半透膜)中,并把它悬挂在盛有蒸馏水的烧瓶里,从而使淀粉与食盐分离,这种方法_______________。
(4)Fe(OH)3胶体加硅酸胶体,胶体变得浑浊,这是发生了____________。
(5)已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中_____%的氢键
参考答案:(1)电泳 (2)丁达尔效应 (3)渗析 (4)胶体的凝聚 (5)15%
本题解析:略
本题难度:一般
2、选择题 化学知识在生产和生活中有着广泛的应用,下列说法中不正确的是( )
A.用天然气代替煤,可防止全球变暖
B.与铜质水龙头连接处的钢质水管易发生锈蚀
C.青霉素的不良反应是过敏反应,因此用药前要进行皮肤敏感试验
D.食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿瘤
参考答案:A.天然气的主要成分为甲烷,故其二氧化碳排放量要比煤炭、石油为低,故A正确;
B.铜与铁能形成原电池,原电池能加快铁的腐蚀,故B正确;
C.青霉素的不良反应是过敏反应,因此用药前要进行皮肤敏感试验,故C正确;
D.食盐加碘是防止人体缺碘而加的营养强化剂,能预防甲状腺肿大,不能预防地方性甲状腺肿瘤,故D错误.
故选D.
本题解析:
本题难度:简单
3、选择题 在铁的电化学腐蚀中,发生还原反应的那个电极上进行的电极反应是( )
A.2H2O+O2+4e-═4OH-
B.2H++2e-═H2
C.4OH--4e-═2H2O+O2
D.Fe-2e-═Fe2+
参考答案:根据原电池工作原理,在铁的电化学腐蚀中,活泼的金属铁作负极,不如铁活泼的金属或导电的非金属作正极,所以铁作负极,正极上得电子发生还原反应,钢铁发生吸氧腐蚀时,正极上氧气得电子和水反应生成氢氧根离子,即2H2O+O2+4e-═4OH-,发生析氢腐蚀时,正极上是氢离子得电子的反应,即2H++2e-═H2,负极失电子变成离子进入溶液,即Fe-2e-=Fe2+.
故选AB.
本题解析:
本题难度:简单
4、填空题 (4分)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
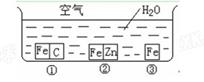
(1)铁被腐蚀的速率由快到慢的顺序是?(填序号)。
(2)铁处于①环境时,正极反应式___________________________
(3)请你为以下钢铁制品选择适当的防锈方法。
A.自行车的链条、齿轮?
B.海水中的轮船?
参考答案:答案略
本题解析:略
本题难度:简单
5、选择题 用如图装置实验,下列叙述不正确的是(? )
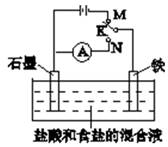
A.K与N连接时,组成原电池装置
B.K与N连接时,石墨电极产生气泡
C.K与M连接时,一段时间后溶液的pH增小
D.K与M连接时,石墨电极的反应为:2Cl--2e-=Cl2↑
参考答案:C
本题解析:
试题分析: 若K与N相连,则外电源断路,石墨、铁、电解质溶液构成闭合回路,形成原电池,铁做负极失去电子Fe-2e-= Fe2+,石墨作正极,H+ 在石墨电极上得到电子被还原2H+ +2e-=H2↑,所以A、B正确;若K与M相连,则外电源接入形成电解池,石墨作阳极,Cl- 先失去电子被氧化2Cl--2e-=Cl2↑,铁做阴极,H+ 在铁电极上得到电子被还原2H+ +2e-=H2↑,所以整个过程实质是电解HCl,HCl的浓度逐渐减小,一段时间后pH增大,故C错误,选C。
本题难度:一般