1、选择题 下列条件下铁钉最容易生锈的是( )
A.浸泡在植物油中
B.浸泡在海水中
C.置于干燥的空气中
D.浸泡在蒸馏水中
参考答案:A、铁钉浸没在植物油中,与水和氧气隔绝,所以不容易生锈,故A错误;
B、浸泡在海水中时,铁钉中的碳、铁和氯化钠溶液能构成原电池发生电化学腐蚀,所以最容易生锈,故B正确;
C、铁钉置于干燥的空气中,与水不接触,所以不容易生锈,故C错误;
D、蒸馏水中没有氧气,所以铁钉浸泡在蒸馏水中时,隔绝了氧气,所以不容易生锈,故D错误.
故选B.
本题解析:
本题难度:一般
2、填空题 某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
②IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4
(1)A中属于还原产物的是______.
(2)Ⅱ中加入MnCO3、Zn2(OH)2CO3的作用是______;
Ⅱ需要加热的原因是______;C的化学式是______.
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______.
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是______.
(5)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______.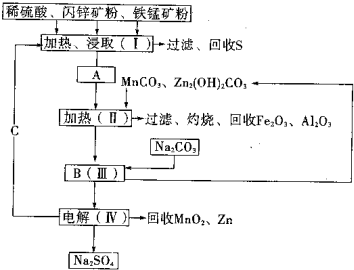
参考答案:(1)比较信息①,A与软锰矿中元素化合价的变化可知,锰元素化合价从+4价降低为+2价,所以A中还原产物为MnSO4,故答案为:MnSO4;
(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝,所以加入MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全,在加热的环境下,金属阳离子的水解更彻底,更易形成沉淀而分离,根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知C为硫酸,
故答案为:增大溶液的PH,使Fe3+和Al3+均生成沉淀;促进Fe3+和Al3+的水解;H2SO4;
(3)该实验的目的就是制备二氧化锰与锌,因而就需要把氧化铝、铁元素、硫元素除去.根据流程图不难得出该生产中除得到MnO2和Zn以外,还可得到的副产品有硫、氧化铁、氧化铝,故答案为:Fe2O3、Al2O3、S、Na2SO4;
(4)根据框图中转化消耗的反应物,如果不考虑生产中的损耗,除矿石外,需购买的化工原料是氢氧化钠和硫酸,故答案为:纯碱和硫酸;
(5)据反应MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4可知MnO2、Zn的物质的量之比为1:1,故可设软锰矿、闪锌矿的质量分别为x、y,得0.7x87:0.8y97=1:1,故x:y=1.03,故答案为:1.03.
本题解析:
本题难度:一般
3、选择题 汽车上用的铅蓄电池是以一组充满海绵状态的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总反应为:Pb+PbO2+2H2SO4 ?2PbSO4+2H2O
?2PbSO4+2H2O
下列叙述正确的是?
A.充电时阴极反应为:Pb + SO42- -2e- =PbSO4
B.放电时,当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为1mol
C.放电时溶液中H+向负极移动
D.充电时阳极附近溶液的pH减小
参考答案:D
本题解析:充电相当于是电解,阴极得到电子,A不正确,应该是PbSO4+2e-=Pb+SO42 -。放电相当于是原电池,根据方程式可知,消耗2mol硫酸时,转移2mol电子,B不正确;原电池中阳离子向正极移动,选项C不正确;充电时阳极失去电子,电极反应式是PbSO4-2e-+2H2O=PbO2+4H++SO42 -,这说明充电时阳极附近溶液的pH减小,答案选D。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养和训练,旨在考查学生电化学原理解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力。该题的关键是明确原电池和电解池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 对下列实验的描述正确的是?
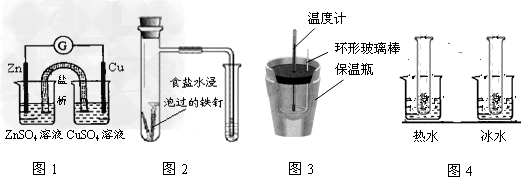
[? ]
A.图1所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性(检流计的偏转方向为电子流的流动方向)
B.图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图3所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热
D.图4所示的实验:根据两试管中溶液颜色的变化(热水中变深、冰水中变浅)判断 是放热反应
是放热反应
参考答案:A
本题解析:
本题难度:一般
5、选择题 如图是探究铁发生腐蚀的装置图。发现开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升。下列说法不正确的是
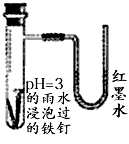
[ ? ]
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应均为:
D.析氢腐蚀的总反应为: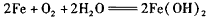
参考答案:D
本题解析:
本题难度:一般