1、填空题 某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的C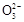 、HC
、HC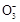 、Al
、Al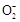 、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是(?)
、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是(?)
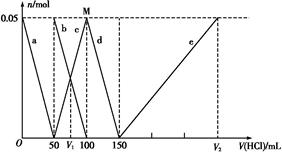
A.原混合溶液中的C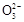 与Al
与Al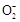 的物质的量之比为1∶2
的物质的量之比为1∶2
B.V1∶V2=1∶5
C.M点时生成的CO2为0.05 mol
D.a线表示的离子方程式为:Al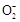 +H++H2O
+H++H2O Al(OH)3↓
Al(OH)3↓
参考答案:D
本题解析:因为酸性有:HCl>H2CO3>HC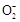 >C
>C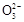 >Al(OH)3,所以在向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸的过程中,首先发生反应①Al
>Al(OH)3,所以在向Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸的过程中,首先发生反应①Al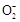 +H++H2O
+H++H2O Al(OH)3↓,则a线表示的是Al
Al(OH)3↓,则a线表示的是Al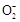 的物质的量,D选项正确,且n(Al
的物质的量,D选项正确,且n(Al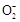 )="n(HCl)=0.05" mol;然后发生反应②C
)="n(HCl)=0.05" mol;然后发生反应②C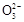 +H+
+H+ HC
HC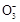 ,b线表示的是C
,b线表示的是C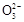 的物质的量,c线表示的是HC
的物质的量,c线表示的是HC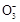 的物质的量,n(C
的物质的量,n(C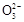 )="n(HCl)=0.05" mol,则n(C
)="n(HCl)=0.05" mol,则n(C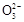 )∶n(Al
)∶n(Al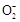 )=1∶1,A选项错;V1表示C
)=1∶1,A选项错;V1表示C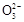 与HC
与HC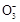 物质的量相等时加入盐酸的体积,此时V1="75" mL,M表示反应C
物质的量相等时加入盐酸的体积,此时V1="75" mL,M表示反应C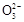 +H+
+H+ HC
HC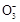 恰好完成,此时并没有放出CO2,C选项错;再后发生反应③H++HC
恰好完成,此时并没有放出CO2,C选项错;再后发生反应③H++HC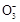
 CO2↑+H2O,HC
CO2↑+H2O,HC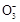 的物质的量对应的是d线,再后发生反应④Al(OH)3+3H+
的物质的量对应的是d线,再后发生反应④Al(OH)3+3H+ Al3++3H2O,Al3+的物质的量对应的是e线,V2="3×50" mL+150 mL="300" mL,V1∶V2=75∶300=1∶4,B选项错。
Al3++3H2O,Al3+的物质的量对应的是e线,V2="3×50" mL+150 mL="300" mL,V1∶V2=75∶300=1∶4,B选项错。
本题难度:一般
2、选择题 下列离子方程式与所述事实相符且正确的是(( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O
C.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O
D.向沸水中滴加FeCl3饱和溶液制取Fe(OH)3胶体:Fe3++3H20
Fe(OH)3↓+3H+
参考答案:A、漂白粉在空气中失效原理是:先生成次氯酸,即ClO-+CO2+H2O=HClO+HCO3-,然后是次氯酸分解,故A错误;
B、氢氧化铝沉淀不能溶于强氨水溶液中,AlCl3溶液中加入过量的浓氨水后,反应为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C、等物质的量的Ba(OH)2稀溶液与NH4HCO3稀溶液混合后反应为:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O,故C正确;
D、向沸水中滴加FeCl3饱和溶液制取Fe(OH)3胶体的方程式为:Fe3++3H20?△?.?Fe(OH)3(胶体)+3H+,故D错误.
故选C.
本题解析:
本题难度:一般
3、选择题 下列相关反应的离子方程式书写正确的是(?)
A.氢氧化铁溶于氢碘酸:Fe(OH)3 +3H+ =Fe3++3H2O
B.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3—+Ba2++2OH— = BaCO3? +2H2O+CO32—
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
D.向含有0.4 mol FeBr2的溶液中通入0.1 mol Cl2反应:2Fe2++Cl2=2Fe3+ +2Cl-
参考答案:D
本题解析:A、Fe3+与I-不能共存,错误;B、反应为HCO3—+Ba2++OH— = BaCO3? +H2O,错误;C、反应为Al3++NH4++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3·H2O,错误。 D、Fe2+的还原性大于Br-,正确。
本题难度:一般
4、简答题 根据方程式:Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O,请回答:
(1)BaSO4属于______,NH3属于______.(填字母)
A、电解质?B、非电解质?C、胶体?D、本身能导电的物质
(2)Ba(OH)2属于______.(填字母)
A、单质?B、酸?C、碱?D、盐
(3)该反应______(填“是”或“不是”)复分解反应.
(4)写出(NH4)2SO4的电离方程式:______.
(5)写出该反应的离子反应方程式:______.
参考答案:(1)BaSO4在熔融状态下能完全电离出钡离子和硫酸根离子,属于盐类,是强电解质;NH3在水溶液里,生成一水合氨,一水合氨能电离出自由移动的铵根离子和氢氧根离子导致导电,不是氨气自身电离,所以氨气是非电解质,
故答案为:A;B;
(2)碱是指在水中电离出的阴离子全部是氢氧根离子的化合物,Ba(OH)2的电离方程式Ba(OH)2═Ba2++2OH-,所以Ba(OH)2是碱,
故答案为:C;
(3)复分解反应主要是化合物相互交换成分,生成新的化合物,Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O,是氢氧根离子和硫酸根离子交换,显然是复分解反应,
故答案为:是;
(4)铵盐均属于可溶性的强电解质,电离不可逆,用“═”,SO42-离子团不能拆,所以硫酸铵的电离方程式应为(NH4)2SO4═2NH4++SO42-,故答案为:(NH4)2SO4═2NH4++SO42-;
(5)Ba(OH)2和(NH4)2SO4,均属于可溶性的强电解质,拆成离子,硫酸钡和水写化学式,该反应的离子反应方程式Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3↑+2H2O,
故答案为:Ba2++2OH-+2NH4++SO42-=BaSO4↓+2NH3↑+2H2O.
本题解析:
本题难度:一般
5、选择题 下列离子方程式书写正确的是( )
A.碳酸氢钠溶液中加入过量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=Al(OH)4-+4NH4+
C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
D.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
参考答案:A、碳酸氢钠溶液中加入过量的石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O,故A错误;
B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C、氯气与水反应:Cl2+H2O=H++Cl-+HClO,故C错误;
D、过氧化钠与水反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故D正确;
故选D.
本题解析:
本题难度:一般